Эндокринная система, гормоны и механизм их действия
Собственно аденилатциклаза представляет собой гликопротеин с молекулярной массой 115 – 150 кДа. В различных тканях идентифицировано 6 ее изоформ, которые взаимодействуют с a-, b- и g-субъединицами, а также с Са2+ кальмодулином. В некоторых видах рецепторов помимо регуляторного стимулирующего (Гс) и регуляторного ингибирующего (Ги) белка идентифицирован дополнительный белок – трансдуцин.
Роль регуляторных белков в передаче гормонального сигнала велика, структуру этих белков сравнивают с “кассетой”, и многообразие ответа связано с высокой мобильностью регуляторного белка. Так, некоторые гормоны могут одновременно активировать в различной степени как Гс, так и Ги. Более того, взаимодействие некоторых гормонов с рецепторными регуляторными белками вызывает экспрессию соответствующих белков, регулирующих уровень и степень гормонального ответа. Активация, как показано выше, регуляторных белков является следствием их диссоциации от гормонально-рецепторного комплекса. В некоторых рецепторных системах в это взаимодействие вовлечено до 20 и более регуляторных белков, которые помимо стимуляции образования цАМФ активируют одновременно и кальциевые каналы.
Определенное количество рецепторов, которые относятся к первой группе, имеющих 7 трансмембранных фрагментов, опосредуют свое действие вторичными мессенджерами, относящимися к производным фосфатидилинозитола: инозитолтрифосфат и диацилглицерин. Инозитолтрифосфат контролирует клеточные процессы за счет генерации внутриклеточного кальция. Эта мессенджерная система может активироваться двумя путями, а именно через регуляторный белок или фосфотирозиновые белки. И в том, и в другом случае далее происходит активирование фосфолипазы С, которая гидролизует полифосфоинозидную систему. Эта система, как указано выше, включает два внутриклеточных вторичных мессенджера, которые образуются из мембранного полифосфоинозида, называемого фосфатидилинозитол-4, 5-бифосфатом (ФИФ2). Комплексирование гормона с рецептором вызывает гидролиз ФИФ2 фосфорилазой, в результате чего и образуются указанные мессенджеры – инозитол трифосфат (ИФ3) и диацилглицерин. ИФ3 способствует повышению уровня внутриклеточного кальция в первую очередь за счет мобилизации последнего из эндоплазматической сети, где он локализутся в так называемых кальциосомах,
а затем за счет поступления в клетку внеклеточного кальция. Диацилглицерин в свою очередь активизирует специфические протеинкиназы и, в частности, протеинкиназу С. Последние фосфорилируют определенные ферменты, ответственные за конечный биологический эффект. Не исключено, что разрушение ФИФ2 наряду с выходом двух мессенджеров и увеличением содержания внутриклеточного кальция индуцирует и образование простагландинов, являющихся потенциальными стимуляторами цАМФ.Посредством этой системы опосредуется действие таких гормонов, как гистамин, серотонин, простагландины, вазопрессин, холецистокинин, соматолиберин, тиролиберин, окситоцин, паратгормон, нейропептид Y, вещество Р, ангиотензин II, катехоламины, осуществляющие действие через a1-адренорецепторы, и др.
В группу фермента фосфолипазы С входят до 16 изоформ, которые в свою очередь подразделяются на b-, g- и d-фосфолипазу С. Показано, что b-фосфолипаза С взаимодействует с регуляторными белками, а g-фосфолипаза С – с тирозинкиназами.
Инозитолтрифосфат осуществляет действие через собственные специфические тетрамерные рецепторы, имеющие молекулярную массу 4х313 кДа. После комплексирования с таким рецептором выявлены так называемые “большие” инозитолтрифосфатные рецепторы или рианодиновые рецепторы, которые также относятся к тетрамерам и имеют молекулярную массу 4х565 кДа. Не исключено, что внутриклеточные кальциевые каналы рианодиновых рецепторов регулируются новым вторичным мессенджером – цАДФ-рибозой (L. Meszaros и соавт., 1993). Образование этого мессенджера опосредуется цГМФ и оксидом азота (NO), который активирует цитоплазматическую гуанилатциклазу. Таким образом, оксид азота может представлять собой один из элементов передачи гормонального действия с участием ионов кальция.
Как известно, кальций находится внутри клетки в связанном с белками состоянии и в свободной форме во внеклеточной жидкости. Идентифицированы такие внутриклеточные белки, связывающие кальций, как кальретикулин и кальсеквестрин. Внутриклеточный свободный кальций, который выполняет роль вторичного мессенджера, поступает из внеклеточной жидкости через кальциевые каналы плазматической мембраны клетки или высвобождается внутриклеточно из связи с белками. Внутриклеточный свободный кальций влияет на соответствующие киназы фосфорилаз лишь будучи связанным с внутриклеточным белком-кальмодулином (схема 3).
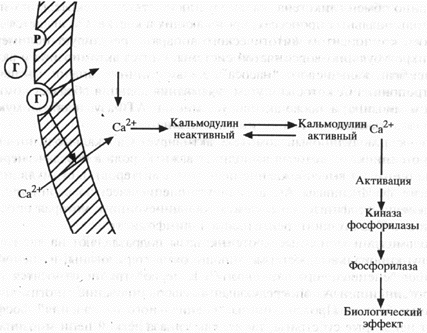
Схема 3. Механизм действия белковых гормонов через СА2+ (объяснения в тексте) Р – рецептор; Г – гормон; Са+белок – внутриклеточный кальций в связанной с белками форме.
Кальмодулин – рецепторный белок с высокой аффинностью к кальцию – состоит из 148 аминокислотных остатков и присутствует во всех содержащих ядро клетках. Его молекулярная масса (мол.м.) – 17000 кДа, каждая молекула имеет 4 рецептора для связывания кальция.
В состоянии функционального покоя концентрация свободного кальция во внеклеточной жидкости выше, чем внутри клетки, благодаря функционированию кальциевого насоса (АТФазы) и транспортировке кальция из клетки в межклеточную жидкость. В этот период кальмодулин находится в неактивной форме. Комплексирование гормона с рецептором приводит к повышению внутриклеточного уровня свободного кальция, который вступает в связь с кальмодулином, превращает его в активную форму и оказывает влияние на кальцийчувствительные белки или ферменты, ответственные за соответствующий биологический эффект гормона.
Повышенный уровень внутриклеточного кальция стимулирует затем кальциевый насос, который “перекачивает” свободный кальций в межклеточную жидкость, снижает его уровень в клетке, вследствие чего кальмодулин переходит в неактивную форму и в клетке восстанавливается состояние функционального покоя. Кальмодулин также воздействует на аденилатциклазу, гуанилатциклазу, фосфодиэстеразу, фосфорилазкиназу, миозинкиназу, фосфолипазу А2, Са2+- и Mg2+-АТФазу, стимулирует высвобождение нейротрансмиттеров, фосфорилирование белков мембран. Изменяя транспорт кальция, уровень и активность циклических нуклеотидов и опосредованно обмен гликогена, кальмодулин участвует в секреторных и других функциональных процессах, протекающих в клетке. Он является динамическим компонентом митотического аппарата, регулирует полимеризацию микротубулярно-ворсинчатой системы, синтез актомиозина и активацию мембран кальциевого “насоса”. Кальмодулин – аналог мышечного белка тропонина С, который путем связывания кальция образует комплекс актина и миозина, а также активирует миозин-АТФазу, необходимую для повторного взаимодействия актина и миозина.
Са2+-кальмодулиновый комплекс активирует Са2+-кальмодулинзависимую протеинкиназу, которая выполняет важную роль в передаче нервного сигнала (синтез и высвобождение нейротрансмиттеров), в стимуляции или угнетении фосфолипазы А2, активирует специфическую серин-треонинпротеиновую фосфатазу, называемую кальцинеурином, которая опосредует действие Т-клеточного рецептора в Т-лимфоцитах.
Кальмодулинзависимые протеинкиназы подразделяют на две группы: многофункциональные, которые хорошо охарактеризованы, и специфические, или “специального назначения”. К первой группе относятся такие, как протеинкиназа А, опосредующая фосфорилирование многих внутриклеточных белков. Протеинкиназы “специального назначения” фосфорилируют некоторые субстраты, такие, как киназа легкой цепи миозина, фосфорилазкиназа и др.
Протеинкиназа С представлена несколькими изоформами (мол.м. от 67 до 83 кДа), которые кодируются 10 различными генами. Классическая протеинкиназа С включает 4 различных изоформы (a-, b1-, b2- и g-изоформы); 4 других белковых изоформы (дельта,- эпсилон,- пи и oмега) и 2 атипичных белковых формы.
Классические протеинкиназы активируются кальцием и диацилглицерином, новые белковые протеинкиназы – диацилглицерином и форболовыми эфирами, а одна из атипичных протеинкиназ не отвечает ни на один из перечисленных активаторов, но для ее активности требуется наличие фосфатидилсерина.
Выше отмечалось, что гормоны, рецепторы которых имеют 7 трансмембранных фрагментов, после образования гормоно-рецепторного комплекса связываются с G-белками, имеющими небольшой молекулярный вес (20-25 кДа) и выполняющими различную функцию. Белки, взаимодействующие с рецепторной тирозинкиназой, называются ras-белками, а белки, участвующие в транспорте пузырька – rab-белками. Активированная форма представляет собой G-белок, комплексированный с ГТФ; неактивная форма ras-белка является следствием его комплексирования с ГДФ. В активировании ras-белка участвует гуаниннуклеотидный высвобождающий белок, а процесс инактивации осуществляется гидролизом ГТФ под влиянием ГТФазы. Активирование ras-белка в свою очередь посредством фосфолипазы С стимулирует образование вторичных мессенджеров: инозитолтрифосфата и диацилглицерина. Ras-белки впервые были описаны как онкогены (A.G. Gilman, 1987), так как повышенная экспрессия, или мутация, этих белков выявлена при злокачественных новообразованиях. В норме ras-белки вовлечены в различные регуляторные процессы, включая рост.
Некоторые белковые гормоны (инсулин, ИФР I и др.) свое первоначальное действие по активированию рецептора осуществляют через гормонально-чувствительную тирозинкиназу. Связывание гормона с рецептором ведет к конформационным изменениям или димеризации, которые вызывают активирование тирозинкиназы и последующее аутофосфорилирование рецептора. После гормональнорецепторного взаимодействия аутофосфорилирование усиливает как активность тирозинкиназы в другом димере, так и фосфорилирование внутриклеточных субстратов. Рецепторная тирозинкиназа является аллостерическим ферментом, в котором внеклеточный домен является регуляторной субъединицей, а внутриклеточный (цитоплазматический) домен – каталитической субъединицей. Активирование или фосфорилирование тирозинкиназы осуществляется через связывание с адапторным или SH2 белком, состоящим из двух SH2 доменов и одного SH3 домена. SH2 домены связывают специфические фосфотирозины рецепторной тирозиновой киназы, а SH3 связывают ферменты или сигнальные молекулы. Фосфорилированные белки (фосфотирозины) укорачиваются на 4 аминокислоты, что и обусловливает их специфическое высокоаффинное связывание с SH2 доменами.
Комплексы (фосфотирозиновые пептиды – SH2 домены) определяют селективность передачи гормонального сигнала. Конечный эффект передачи гормонального сигнала зависит от двух реакций – фосфорилирования и дефосфорилирования. Первая реакция находится под контролем различных тирозинкиназ, вторая – фосфотирозиновых фосфатаз. К настоящему времени идентифицировано более 10 трансмембранных фосфотирозиновых фосфатаз, которые подразделяются на 2 группы: а) большие трансмембранные белки/тендемные домены и б) небольшие внутриклеточные ферменты с одним каталитическим доменом.
Внутриклеточные фрагменты фосфотирозиновых фосфатаз отличаются большим разнообразием. Считается, что функция SH2 доменовых фосфотирозиновых фосфатаз (I и II типа) заключается в уменьшении сигнала посредством дефосфорилирования фосфорилирующих участков на рецепторной тирозинкиназе или усилении сигнала через связывание тирозинфосфорилирующих сигнальных белков на одном или обоих доменах SH2, а также передаче сигнала посредством взаимодействия одного белка SH2 с другим его белком или инактивирование процессом дефосфорилирования тирозинфосфорилированных вторичных мессенджерных молекул, таких, как фосфолипаза С-g или src-тирозинкиназа.
У некоторых гормонов передача гормонального сигнала осуществляется путем фосфорилирования остатков аминокислоты тирозина, а также серина или треонина. Характерным в этом плане является рецептор к инсулину, в котором может происходить фосфорилирование как тирозина, так и серина, причем фосфорилирование серина сопровождается снижением биологического эффекта инсулина. Функциональная значимость одновременного фосфорилирования нескольких аминокислотных остатков рецепторной тирозинкиназы не совсем понятна. Однако этим достигается модулирование гормонального сигнала, который схематически относят ко второму уровню рецепторных сигнальных механизмов. Этот уровень характеризуется активированием нескольких белковых киназ и фосфатаз (таких, как протеинкиназа С, цАМФ-зависимая протеинкиназа, цГМФ-зависимая протеинкиназа, кальмодулинзависимая протеинкиназа и др.), осуществляющих фосфорилирование или дефосфорилирование сериновых, тирозиновых или треониновых остатков, что вызывает соответствующие конформационные изменения, необходимые для проявления биологической активности.
Следует отметить, что такие ферменты, как фосфорилаза, киназа, казеиновая киназа II, ацетил-СоА карбоксилазная киназа, триглицеридная липаза, гликогенфосфорилаза, белковая фосфатаза I, АТФ цитратлиаза активируются путем процесса фосфорилирования, а гликогенсинтаза, пируватдегидрогеназа и пируваткиназа активируются процессом дефосфорилирования.
Третий уровень регуляторных сигнальных механизмов в действии гормонов характеризуется соответствующим ответом на клеточном уровне и проявляется изменением метаболизма, биосинтеза, секреции, роста или дифференцировки. Это включает процессы транспорта различных веществ через клеточную мембрану, синтез белков, стимуляцию рибосомальной трансляции, активирование микроворсинчатой тубулярной системы и транслокацию секреторных гранул к мембране клетки. Так, активирование транспорта аминокислот, глюкозы через клеточную мембрану осуществляется соответствующими белками-транспортерами через 5-15 минут после начала действия таких гормонов, как СТГ и инсулин. Различают 5 белков-транспортеров для аминокислот и 7 – для глюкозы, из которых 2 относятся к натрийглюкозным симпортерам или котранспортерам.
Вторичные мессенджеры гормонов влияют на экспрессию генов, модифицируя процессы транскрипции. Так, цАМФ регулирует скорость транскрипции ряда генов, ответственных за синтез гормонов. Это действие опосредуется цАМФ-ответным элементом активирующего белка (CREB). Последний белок (CREB) комплексируется со специфическими участками ДНК, являясь общим транскрипционным фактором.
Многие гормоны, взаимодействующие с рецепторами, расположенными на плазматической мембране, после образования гормоно-рецепторного комплекса подвергаются процессу интернализации, или эндоцитозу, т.е. транслокации, или переносу гормоно-рецепторного комплекса внутрь клетки. Этот процесс происходит в структурах, называемых “покрытые ямки”, расположенных на внутренней поверхности клеточной мембраны, выстланной белком клатрином. Агрегированные таким образом гормоно-рецепторные комплексы, которые локализуются в “покрытых ямках”, затем интернализируются путем инвагинации мембраны клетки (механизм очень напоминает процесс фагоцитоза), превращаясь в пузырьки (эндосомы или рецептосомы), а последние транслоцируются внутрь клетки.
Во время транслокации эндосома подвергается процессу ацидофикации (подобно тому, что происходит в лизосомах), результатом чего может быть деградация лиганды (гормона) или диссоциация гормоно-рецепторного комплекса. В последнем случае высвободившийся рецептор возвращается на клеточную мембрану, где он повторно взаимодействует с гормоном. Процесс погружения рецептора вместе с гормоном внутрь клетки и возврат рецептора на мембрану клетки называется процессом рециклирования рецептора.
В период функционирования рецептора (период полураспада рецептора составляет от нескольких до 24 часов и более) он успевает осуществить от 50 до 150 таких “челночных” циклов. Процесс эндоцитоза является составной или дополнительной частью рецепторного сигнального механизма в действии гормонов.Помимо этого, с помощью процесса интернализации осуществляется деградация белковых гормонов (в лизосомах) и клеточная десенситизация (снижение клеточной чувствительности к гормону) путем уменьшения количества рецепторов на клеточной мембране. Установлено, что судьба гормоно-рецепторного комплекса после процесса эндоцитоза различна. У большинства гормонов (ФСГ, ЛГ, хорионический гонадотропин, инсулин, ИФР 1 и 2, глюкагон, соматостатин, эритропоэтин, ВИП, липопротеиды низкой плотности) эндосомы внутри клетки подвергаются диссоциации. Освободившийся рецептор возвращается на мембрану клетки, а гормон подвергается процессу деградации в лизосомальном аппарате клетки.
У других гормонов (СТГ, интерлейкин-2, эпидермальный, нервный и тромбоцитарный факторы роста) после диссоциации эндосом рецептор и соответствующий гормон подвергаются процессу деградации в лизосомах.
Некоторые гормоны (трансферин, маннозо-6-фосфат, содержащие белки, и незначительная часть инсулина, СТГ в некоторых тканях-мишенях) после диссоциации эндосом возвращаются, как и их рецепторы, на клеточную мембрану. Несмотря на то, что у перечисленных гормонов имеет место процесс интернализации, нет единого мнения о непосредственном внутриклеточном действии белкового гормона или его гормоно-рецепторного комплекса.
Рецепторы к гормонам коры надпочечников, половым гормонам, кальцитриолу, ретиноивой кислоте, тироидным гормонам локализованы внутриклеточно. Перечисленные гормоны липофильны, транспортируются белками крови, имеют длительный период полураспада и их действие опосредуется гормоно-рецепторным комплексом, который, связываясь со специфическими областями ДНК, активирует или инактивирует специфические гены.
Связывание гормона с рецептором приводит к изменениям физико-химических свойств последнего, и этот процесс называется активацией или трансформацией рецептора. Изучение трансформации рецепторов in vitro показало, что температурный режим, наличие гепарина, АТФ и других компонентов в инкубационной среде изменяют скорость этого процесса.
Нетрансформированные рецепторы являются белком с молекулярной массой 90 кДа, который идентичен стрессовому или белку температурного шока с той же молекулярной массой (M. Catell и соавт., 1985). Последний белок встречается в a- и b-изоформах, которые кодируются различными генами. Аналогичная ситуация наблюдается и в отношении стероидных гормонов.
Помимо стрессового белка с мол. м. 90 кДа, в нетрансформированном рецепторе выявлен белок с мол. м. 59 кДа (M. Lebean и соавт., 1992), названный иммунофилином, который непосредственно не связан с рецептором стероидных гормонов, но образует комплексы с белком мол. м. 90 кДа. Функция белка иммунофилина недостаточно ясна, хотя его роль в регуляции функции рецептора стероидных гормонов доказана, так как он связывает иммуносупрессивные вещества (например, рапамицин и FK 506).


Комментарии
аймеи 2009.12.06 19:58
камила 2009.05.29 01:50
камила 2009.05.29 01:50
Смотреть все комментарии - 3
Ваш комментарий