Современные представления об этиологии, патогенезе, классификации и принципах лечения фибрилляции предсердий
Дзяк Г.В., академик АМН Украины, доктор медицинских наук, профессор, заведующий кафедрой
Ханюхов А.А., кандидат мед. наук, ассистент
Дзяк В.Г., кандидат мед. наук
Кафедра госпитальной терапии №2 Днепропетровской государственной медицинской академии
Еще с древнейших времен наличие у пациента нерегулярного пульса расценивалось как проявление болезни. Первое документированное наблюдение о нарушении ритма сердца человека принадлежит личному врачу китайского императора Хуанг Ти Ней Чинг Су Вену, жившему примерно за 2000 лет до нашей эры. В своем фундаментальном трактате "Внутренняя медицина" он писал: "…когда пульс больного нерегулярный, слабый, едва ощутимый, то импульс жизни человека угасает". Приоритет описания фибрилляции предсердий (ФП) принадлежит Уильяму Харвею, который в 1628 году наблюдал подобное нарушение ритма и решил дать ему вышеупомянутое название. Огромный прорыв в диагностике ФП произошел после открытия Уильямом Эйнтховеном в 1900 году электрокардиографии. Первая электрокардиографическая запись ФП у человека произведена в 1909 году, ее выполнили Ротбергер и Винтерберг [10]. С тех пор были сделаны существенные успехи в понимании патогенеза ФП и поиске оптимальных схем ведения пациентов, страдающих таким нарушением ритма сердца.
В наше время ФП определяют как суправентрикулярную тахикардию, характеризующуюся учащенным хаотичным и некоординированным возбуждением и сокращением отдельных мышечных волокон предсердий (от 350 до 600 в мин.) и сопровождающуюся низким сердечным выбросом вследствие нарушения наполнения желудочков кровью и нерегулярного их сокращения, желудочковой дисфункцией и повышенным риском развития тромбоэмболических инсультов. ФП является в основном геронтологической проблемой, поскольку распространенность этого заболевания в популяции существенно увеличивается с возрастом. Так, в возрасте от 40 до 50 лет ФП встречается у 0,5% населения, от 50 до 60 лет - у 1%, от 60 до 70 лет - у 4%, от 70 до 80 лет - у 9%, свыше 80 лет - у 15%. Следует также отметить, что ФП у мужчин встречается в 1,5 - 3,4 раза чаще, чем у женщин [7]. По данным 5-летнего исследования SPRINT, госпитальная летальность у пациентов с ФП была в 1,6 раз выше, а годовая и 5-летняя летальность при пароксизмальной форме ФП в 2,4 и 1,7 раза выше, чем у больных без нее [3]. Основными прогностически неблагоприятными факторами, связанными с ФП, являются угроза развития тромбоэмболических осложнений (в первую очередь ишемических инсультов) и возникновение и/или прогрессирование сердечной недостаточности [5].
В соответствии с рекомендациями, разработанными экспертами Американского и Европейского обществ кардиологов, выделяют следующие формы ФП: пароксизмальная (самостоятельно купирующаяся), персистирующая (самостоятельно не купирующаяся), перманентная (постоянная). Пароксизмальная форма может быть впервые возникшей и рецидивирующей (2 и более приступов). При этом приступ может длиться от 30 секунд до 7 дней (в большинстве случаев в пределах 24 часов). Персистирующая форма также может быть впервые возникшей или рецидивирующей, обычно длится более 7 дней и купируется с помощью лекарственных препаратов или электроимпульсной терапии. Случаи, когда персистирующая форма длится более 1 года, а восстановление синусового ритма не производилось, в том числе в связи с наличием противопоказаний, классифицируют как постоянную форму фибрилляции предсердий [6].
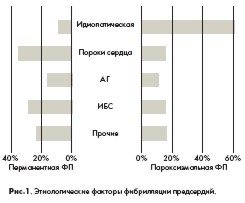
В зависимости от этиологии существуют следующие формы ФП: ревматическая (клапанная); неревматическая (неклапанная), возникающая при других заболеваниях (хроническая сердечная недостаточность (ХСН), ишемическая болезнь сердца (ИБС), артериальная гипертензия (АГ), кардиомиопатии, сахарный диабет, ожирение); изолированная ( идиопатическая) форма, наблюдающаяся у пациентов в возрасте до 60 лет, у которых отсутствуют клинические и эхокардиографические признаки сердечно-легочного заболевания (до 15% от общего числа больных с ФП) [4].
Как показывают результаты ряда исследований, этиология перманентной и пароксизмальной форм ФП различна. Примерно у 90% больных с перманентной формой эта аритмия возникает на фоне органических заболеваний сердца. При этом клапанные пороки сердца выявляются более чем у 30%, ИБС - у 20%, АГ - у 15% и кардиомиопатии - у 10% больных. У 10% больных с перманентной ФП констатируют идиопатическую форму заболевания. При пароксизмальной ФП, напротив, до 60% больных составляют лица с идиопатической формой ФП, а органические заболевания сердца играют значительно меньшую роль (рис. 1) [2].
Рассматривая причины возникновения ФП, следует различать факторы предрасполагающие и воздействующие (реализующие эти возможности). В настоящее время выделяют анатомические (структурные) и электрофизиологические факторы риска ФП. К анатомическим факторам риска относят увеличение объема предсердий (особенно левого), расширение ушка левого предсердия, наличие внутрипредсердных тромбов и опухолей. Следует также отметить, что метаболические изменения, возникающие в левом предсердии, формируют готовность левого предсердия к пароксизму фибрилляции [3].
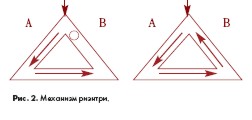
Существуют две гипотезы возможного электрофизиологического механизма возникновения ФП: усиленный автоматизм в одном или нескольких быстро деполяризующихся участках; риэнтри с одним или несколькими кругами циркуляции возбуждения. Независимо от механизма возникновения ФП пусковым ее фактором в большинстве случаев выступают экстрасистолы. Эктопический очаг возбуждения, приводящий к возникновению ФП, может локализоваться в устье одной или нескольких легочных вен, в правом предсердии, а иногда в верхней полой вене или коронарном синусе.
Любая тахикардия, возникающая по механизму риэнтри, требует наличия неоднородности рефрактерности и/или скорости распространения импульсов, что приводит к возникновению функционально различных путей проведения. Для возникновения механизма риэнтри, в соответствии с классическими представлениями, необходимо три условия: наличие замкнутого контура проведения, антероградная блокада проведения в одном из участков контура и замедленное распространение возбуждения в другом участке контура (петли) (рис. 2). При этих условиях импульсы, подошедшие к разветвлению проводящих путей, блокируются в сегменте В, относительно медленно распространяются по сегменту А, а затем, если к этому моменту функциональная блокада в сегменте В исчезнет, ретроградно проводятся и через него. Далее циркуляция возбуждения может продолжаться [2].
Для объяснения электрофизиологического механизма ФП, возможности ее возникновения, персистирования и купирования была выдвинута концепция длины волны (ДВ). Длина волны практически равна длине петли риэнтри и представляет собой тот путь, который проходит возбуждение за время, соответствующее продолжительности эффективного рефрактерного периода (ЭРП). Она равна произведению ЭРП на скорость распространения импульсов по предсердиям. От ДВ зависит размер и количество петель риэнтри, которые могут циркулировать в предсердиях. Небольшая ДВ ассоциируется со значительным количеством петель риэнтри и достаточной устойчивостью ФП к попыткам купирования. Обратное имеет место при относительно большой ДВ [2, 5]. Объем обследования пациентов с ФП включает тщательный сбор анамнеза (уточнить наличие и характеристику симптомов; выяснить дату или время первого эпизода ФП, сопровождающегося клинической симптоматикой, и/или дату выявления бессимптомной ФП; определить частоту возникновения, длительность, провоцирующие факторы, ЧСС во время и вне пароксизма, способ окончания приступа - самостоятельно или необходимо вмешательство), физикальное обследование, электрокардиографию, эхокардиографию (состояние клапанного аппарата, размер левого предсердия, наличие гипертрофии и функция левого желудочка, тромбы в полости левого предсердия), оценку функции щитовидной железы, рентгенографию. К дополнительным методам обследования таких больных можно отнести нагрузочный тест (индукция ФП при проведении теста, выявление ишемии), холтеровское мониторирование (при неуточненном виде аритмии, пароксизмальной форме ФП, для оценки частоты сокращений желудочков в случае постоянной формы ФП) и электрофизиологическое исследование (уточнение механизма тахиаритмии с широкими комплексами; возможность определения предшественников ФП, таких как трепетание предсердий и суправентрикулярная тахикардия; для определения зоны абляции или деструкции / модификации атриовентрикулярного соединения) [3, 6]. Пациенты, страдающие ФП, как правило, предъявляют жалобы на сердцебиение, ощущение перебоев в работе сердца, дискомфорт в грудной клетке, боли в области сердца, одышку, слабость, головокружение и/или обмороки, снижение внимания, ухудшение памяти. Необходимо отметить, что в 10 - 15% случаев течение ФП может быть бессимптомным (как правило, у лиц, перенесших инфаркт миокарда).
К основным подходам к ведению пациентов с ФП относят восстановление синусового ритма, контроль частоты желудочковых сокращений и профилактику тромбоэмболических осложнений. Теоретически, восстановление и сохранение синусового ритма предпочтительнее, так как при этом должен снизиться риск тромбоэмболий. Недавно опубликованы результаты двух рандомизированных многоцентровых исследований (AFFIRM и RACE), авторы которых попытались ответить на вопрос: что лучше - восстановить синусовый ритм или контролировать темп сокращений желудочков? Было продемонстрировано,
Препараты, используемые для фармакологической кардиоверсии, приведены в таблице 2. Впервые успешную электроимпульсную кардиоверсию осуществили в 1958 г. А.А.Вишневский и Б.М.Цукерман у больной с митральным стенозом во время митральной комиссуротомии. Вскоре после этого наружная (трансторакальная) кардиоверсия стала рутинной процедурой, которая в настоящее время является методом выбора при ФП. Трансторакальная кардиоверсия (ТТК) представляет собой достаточно простой, надежный и эффективный метод, позволяющий восстановить синусовый ритм примерно у 85% больных с ФП различной продолжительности. Электрический разряд за счет одномоментной деполяризации миокарда создает однородную электрофизиологическую среду в предсердиях, что прекращает циркуляцию патологических импульсов по петлям риэнтри.
ТТК выполняется как ургентная процедура или в плановом порядке. Ургентная ТТК показана больным с резко выраженной артериальной гипотонией, сердечной астмой, приступом стенокардии, развившимся на фоне тахисистоличской формы ФП. Она проводится также при пароксизмах ФП у больных с синдромом WPW, при котором существует реальный риск возникновения фибрилляции желудочков. Показания к плановой ТТК определяются не столько вероятностью успеха самого вмешательства, сколько возможностью последующего сохранения синусового ритма на относительно продолжительный период. Наиболее подходящими кандидатами для плановой ТТК считаются больные без митрального стеноза, с диаметром левого предсердия менее 4,5 - 5,0 см и ФП продолжительностью не более одного года. Перед ее проведением необходима коррекция метаболических и электролитных нарушений. Единственным противопоказанием к ТТК является интоксикация сердечными гликозидами [2]. Недавно была предложена методика внутренней (эндокардиальной) кардиоверсии (ВК), при которой электрический разряд высокой энергии (200 - 300 Дж) наносится между электродом, введенным в полость правого предсердия, и наружным электродом. ВК превосходит по эффективности ТТК и показана больным, у которых ТТК и медикаментозная терапия не обеспечивают восстановления синусового ритма [2].
Одним из последних достижений в лечении больных с пароксизмальной формой ФП является применение имплантируемых устройств, обеспечивающих кардиоверсию при возникновении спонтанных эпизодов ФП. Предсердные имплантируемые дефибрилляторы (или атриовертеры) позволяют с помощью импульсов относительно небольшой энергии (менее 6 Дж) максимально быстро, эффективно и безопасно восстановить синусовый ритм при возникновении пароксизма ФП. С этой целью один электрод (катод) устанавливается в правом предсердии, а другой электрод (анод) - в коронарном синусе. Выпускаемые промышленные образцы атриовертеров содержат три электрода, один из которых находится в правом желудочке и служит для синхронизации разряда с зубцом R. Распознавание ФП в данных устройствах осуществляется автоматически. Во избежание неправильной диагностики ФП атриовертер сначала программируется таким образом, что он может только распознать ФП, но не наносить разряд. Кардиоверсия становится возможной только после решения врача (режим "активации врачом"). Затем устанавливается программа автоматического включения или режим "активации пациентом".
Обеспечиваемая атриовертером быстрая кардиоверсия предупреждает негативные последствия электрофизиологического ремоделирования - ситуацию, при которой "ФП порождает ФП". Наиболее оправданным считают применение атриовертеров на фоне фармакологической терапии, направленной на предупреждение пароксизмов ФП [5].
Как уже указывалось выше, стратегия контроля частоты сокращений желудочков у пациентов с ФП является альтернативой восстановлению синусового ритма.
Препараты, используемые для контроля частоты сокращений желудочков, указаны в таблице 3.
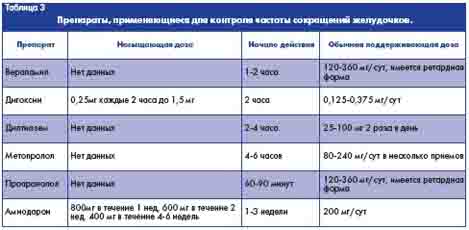
Критерием эффективности контроля частоты сокращений желудочков является темп их сокращений в пределах 60 - 80 в минуту в покое и 80 - 120 в минуту при физической нагрузке. Наиболее предпочтительным следует считать применение бета-адреноблокаторов, которые обеспечивают адекватный контроль темпа сокращений желудочков как в покое, так и при физической нагрузке. Антагонисты кальция используются при наличии противопоказаний к назначению бета-блокаторов. Сердечные гликозиды не способны эффективно контролировать темп сокращений желудочков при физической нагрузке [4]. Тромбоэмболические осложнения играют ведущую роль в структуре заболеваемости и смертности больных с ФП. Они наиболее часто возникают вскоре после начала ФП, в течение первого года и в ранний период после восстановления синусового ритма. Главным источником эмболов при ФП является ушко левого предсердия, где сосредоточено до 90% всех внутрисердечных тромбов, а основной их "мишенью" - головной мозг (таблица 4). ФП является причиной примерно 20% всех цереброваскулярных эпизодов ишемического характера. Риск тромбоэмболических осложнений наиболее значителен у пациентов пожилого возраста. Так, у больных в возрасте 50-59 лет частота их возникновения составляет 1,5%, а в возрасте 80-89 лет - 30% в год. У пациентов старше 80 лет не менее 35% ишемических инсультов обусловлены ФП [8, 9].
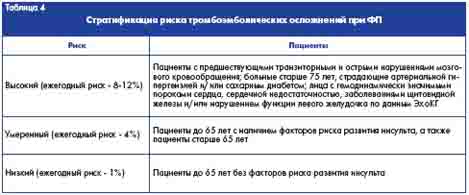
К факторам риска инсульта при ФП относят возраст более 65 лет, сахарный диабет, артериальную гипертензию, хроническую сердечную недостаточность (фракция выброса левого желудочка менее 40%), гемодинамически значимые пороки сердца, тромбоэмболию в анамнезе [10].
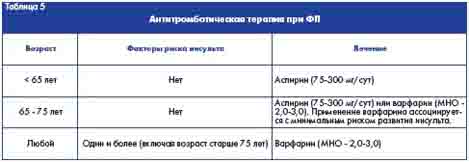
При высоком риске тромбоэмболических осложнений показано применение варфарина (МНО - 2,0-3,0); при умеренном риске - варфарина (МНО - 2,0-3,0) или аспирина (75 - 300 мг/сут); при низком риске - аспирина (75 - 300 мг/сут) [8, 10]. Если ФП продолжается более 48 часов, то в течение 3 недель до восстановления ритма сердца и на протяжении не менее 4 недель после кардиоверсии для профилактики тромбоэмболии проводят противосвертывающую терапию [2, 5]. У больных, у которых синусовый ритм не восстанавливается или имеется постоянная форма ФП, в соответствии с международными рекомендациями следует постоянно проводить антикоагулянтную терапию (таблица 5).
В последние годы достаточно широкое распространение получило хирургическое лечение ФП. В 80-е годы прошлого века выполнялась операция типа "коридор", при которой с помощью линейных надрезов на правое предсердие создавался фиброзный туннель, соединяющий синусовый узел с АВ-узлом. Это обеспечивало восстановление правильного ритма желудочков, но не предсердий, электрическая активность которых оставалась хаотической. Основным недостатком этой операции является сохраняющийся риск тромбоэмболических осложнений, в связи с чем необходима пожизненная антикоагулянтная терапия. В настоящее время наиболее популярна операция типа "лабиринт", при которой на оба предсердия наносятся Т-образные надрезы, производится иссечение ушек предсердий и изоляция легочных вен, что обеспечивает разделение предсердий на небольшие изолированные друг от друга отделы, не способные поддерживать ФП. Надрезы наносятся таким образом, чтобы сохранить проведение импульсов от синусового узла к АВ-узлу. Операция типа "лабиринт" является наиболее эффективным методом радикального лечения ФП. Необходимость торакотомии, искусственного кровообращения, а также значительная продолжительность вмешательства (5-6 часов) не позволяют широко применять операцию данного типа. Она показана больным с частыми, тяжело протекающими пароксизмами ФП, рефрактерными к медикаментозной терапии [1].
Стремление к тому, чтобы вмешательства, основанные на принципе "лабиринта",
РЧКА и модификация АВ-узла являются паллиативными и показаны тем больным с тахисистолической формой хронической ФП, у которых медикаментозная терапия не обеспечивает должного контроля частоты сокращений желудочков (ЧСЖ). РЧКА АВ-узла предполагает создание полной АВ-блокады и имплантацию кардиостимулятора. Эта манипуляция не только устраняет ряд симптомов ФП, особенно сердцебиения, но и приводит к улучшению фракции выброса левого желудочка и повышению толерантности к физическим нагрузкам. Радиочастотная катетерная модификация АВ-узла является более тонким и совершенным методом и направлена на замедление распространения импульсов от предсердий к желудочкам. Она позволяет добиться хороших результатов примерно у 75% больных ФП с неконтролируемой ЧСЖ. У 15% больных модификация АВ-узла осложняется полной поперечной блокадой, а у 10% больных контроль ЧСЖ утрачивается через несколько месяцев после вмешательства [2]. При хронической форме ФП основным показанием к имплантации кардиостимулятора (КС) является симптоматическая брадикардия, вызванная АВ-блокадой, в частности, полной поперечной блокадой (феномен Фредерика). В данной ситуации показана имплантация КС, который обеспечивает адекватный уровень ЧСС. Наибольшей популярностью в настоящее время пользуются пейсмекеры, работающие в режиме "по требованию" (по международной номенклатуре - VVI). В КС данного типа задается тот уровень частоты стимуляции, который обеспечивает ЧСЖ в пределах 60 - 70 в мин. При спонтанном увеличении ЧСЖ выше этого уровня "сенсорный" электрод КС генерирует импульсы, прекращающие кардиостимуляцию. Более совершенными являются устройства частотно-адаптивного типа (VVIR), которые позволяют обеспечить адекватное увеличение ЧСЖ при физической нагрузке. Они содержат специальный датчик, реагирующий на вибрацию. При ходьбе вибрационный датчик посылает сигналы, увеличивающие частоту разрядов КС [1, 11].
В заключение хочется еще раз обратить внимание широкого круга практических врачей на необходимость адекватного ведения пациентов с ФП с использованием современных методик лечения, включая медикаментозную и электроимпульсную терапию, не забывать о возможности хирургического лечения этой категории пациентов. И самое главное, помнить, что врач, который не назначает антитромботическую терапию больным с ФП, подвергает их жизнь огромному риску.
Литература
1. Бокерия Л.А., Ревишвили А.Ш., Ольшанский М.С. Хирургическое лечение фибрилляции предсердий: история вопроса и перспективы // Progress in Biomedical Research. - 1997. - T. 2. - № 2. - С. 74 - 83.
2. Джанашия П.Х., Назаренко В.А., Николенко С.А. Мерцательная аритмия: современные концепции и тактика лечения. - М., 2001. - 107 с.
3. Кушаковский М.С. Фибрилляция предсердий (причины, механизмы, клинические формы, лечение и профилактика). - СПб.: ИКФ "Фолиант", 1999. - 176 с.
4. Мазур Н.А. Фибрилляция предсердий // Клиническая фармакология и терапия. - 2003. - № 3. - С. 32 - 35.
5. Мерцательная аритмия / Под ред. Бойцова С.А. - Санкт-Петербург: "ЭЛБИ-СПБ", 2001. - 335 с.
6. Рекомендації Українського наукового товариства кардіологів з лікування фібриляції і тріпотіння передсердь та профілактики раптової смерті // Український кардіологічний журнал. - 2003. - № 2 (додаток). - С. 4 - 23.
7. Chung S., Blackshear J., Shen W-K et al. // Epidemiology and natural history of atrial fibrillation: clinical implications. - JACC. - 2001. - #37. - P. 371 - 378.
8. Deplanque D., Corea F., Arquizan C. et al. // Stroke and atrial fibrillation: is stroke prevention treatment appropriate beforehand ? - Heart. - 1999. - #92. - P. 563 - 569.
9. Hart R., Halperin J. // Atrial fibrillation thromboembolism: a decade of progress in stroke prevention - Ann. Intern. Med. - 1999. - # 131. - P. 688 - 695.
10. Lip G.Y.H. Atrial Fibrillation in Clinical Practice. - London: Martin Dunitz Ltd., 2001. - 234 P.
11. Wellens H., Sie H., Smeets J. // Surgical treatment of atrial fibrillation. - J. Cardiovascular Electrophysiol. - 1998. - # 918 (Suppl). - P. 151 - 154.
Medicus Amicus 2004, #2


Ваш комментарий