Императивное недержание мочи
Н.А.Лопаткин, А.В.Сивков, С.С.Толстова.
Императивное недержание мочи является распространенной и в то же время нерешенной проблемой. По данным SIFO Group Survey - 16% населения старше 40 лет имеют симптомы гиперактивного детрузора, причем в возрасте 40 - 44 лет - в 5%, а старше 75 лет - в 75% наблюдений.
В России данные распространенности следующие: до 40 лет - 2%, в 40 - 75 лет и старше -16%. Это состояние характеризуется такими симптомами, как учащенное мочеиспускание (85%), императивные позывы (54%) и неудержание вследствие нестабильных сокращений детрузора (36%). Преобладающий состав пациентов - женщины старше 55 лет (Балан В.Е., 1996).
Факторами, способствующими возникновению дизурии и недержания мочи у женщин, являются перименопауза и климакс, роды, операции на органах малого таза, урогенитальные инфекции. Пациент может страдать только императивным недержанием мочи или в сочетании с недержанием мочи при напряжении, что определяется как комбинированная форма недержания мочи (син. - моторно-стрессовое недержание). Оба этих состояния являются медико-социальной и экономической проблемой, негативно влияющей на качество жизни пациента. Пациенты, страдающие императивными позывами к мочеиспусканию, учащенным мочеиспусканием или неудержанием, часто недооценивают важность этих проблем и не предъявляют соответствующих жалоб при обращении к врачу.
Императивное недержание (гиперактивный детрузор) и недержание мочи при напряжении являются распространенными состояниями у пациентов всех возрастных и социальных групп.
Дифференцированный диагноз этих двух состояний, определение причины учащенного мочеиспускания и императивных позывов являются необходимым условием выбора оптимального вида лечения.
Патофизиология гиперактивного детрузора.
Патогенез гиперактивности детрузора может быть разносторонним. Обращают на себя внимание его нейрогенный и миогенный компоненты. Чувствительная иннервация периферических афферентных нервов заканчивается в мочевом пузыре, и повреждение центральных ингибирующих путей усиливает проявление примитивных рефлексов мочеиспускания, которые, в свою очередь, и могут стать пусковым моментом для гиперактивности детрузора (de Groat, 1997). Такими же факторами могут быть изменения в свойствах, структуре и иннервации детрузора. Таким образом, частичная денервация детрузора может быть причиной изменений в клетках гладкой мускулатуры детрузора и приводить к возрастанию возбудимости, ускорению прохождения нервного импульса и, соответственно, к координированным миогенным сокращениям всего детрузора (Brading, 1997). Andersson (1997) предположил, что усиленная афферентная активность, сниженный ингибирую-щий контроль ЦНС и/или периферических ганглиев и повышенная чувствительность к эфферентной стимуляции детрузора изолированно или в комбинации задействованы в патогенезе гиперактивного детрузора.
В последнее время определилась тенденция более широкого определения понятия "гиперактивный детрузор". Не исключено, что условное разделение понятия гиперактивности детрузора на симптоматическое и уродинамическое, предложенное Р. Abrams и А. Wein (1997), способствовало расширению самого понятия и включению в его определение соответствующих симптомов. Симптоматический гиперактивный детрузор является состоянием, для которого характерны симптомы учащенного мочеиспускания, императивные позывы к мочеиспусканию, неудержание или рефлекторное недержание или сочетание этих симптомов. У пациентов с гиперактивностью детрузора могут иметь либо не иметь место неврологические (нейрогенные) причины данных симптомов.
Уродинамическое понятие гиперактивности детрузора - это наличие неконтролируемых сокращений детрузора, обусловливающих вышеперечисленные симптомы, включает в себя гиперрефлексию детрузора (вследствие нейрогенной причины) и нестабильность детрузора (ненейрогенной или неизвестной причины). Это связано с тем, что пациенты с вышеперечисленными симптомами, прежде всего, обращаются к врачам общей практики, участковым терапевтам, невропатологам, гинекологам, хирургам, педиатрам, геронтологам, а затем уже - к урологам.
Гиперактивный детрузор ("нестабильный детрузор") и присущие ему симптомы широко известны, и, может быть, не всем пациентам необходимо сразу обращаться к урологу. Существует и другой аспект данной проблемы: определенное число урологических пациентов, страдающих императивным недержанием, имеют симптомы, характерные для простатита и цистита. Следовательно, понятие гиперактивного детрузора должно быть понятно и принято, прежде всего, врачами общей практики. Они первые проводят обследование пациента, включающее выявление жалоб, анамнеза заболевания, оценку симптомов, проводят осмотр и оценивают данные клинического анализа мочи.
Установлению предварительного диагноза способствует приведенная ниже анкета.
| Симптом | ||
| Императивные позывы | есть | нет |
| Учащенное мочеиспускание (>8 раз за сутки) | есть | нет |
| Подтекание мочи во время физической нагрузки, например, кашле, чихании, поднятии тяжестей и т.д. |
нет | есть |
| Количество мочи, выделяющееся при каждом эпизоде недержания |
большое | незначительное |
| Способность добраться до туалета вовремя, при императивном позыве |
есть | нет |
| Желание помочиться в ночное время | обычно | редко |
| Предварительный диагноз | гиперактивный детрузор | недержание мочи при напряжении |
Врач общей практики может начать лечение в случае наличия симптомов учащенного мочеиспускания, императивных позывов, неудержания при неизмененном анализе мочи. Следует обратиться к специалисту, если при предварительно установленном диагнозе - гиперактивный детрузор - не отмечается эффекта от начальной терапии в течение 2-3 месяцев, имеется гематурия без бактериурии, симптомы предположительно связаны с неэффективным опорожнением мочевого пузыря (наличие задержки мочеиспускания, вялой струи мочи, выделения мочи каплями в конце мочеиспускания) и при подозрении на наличие заболеваний нервной или эндокринной системы.
Определенную информацию дают дневники микций (рис. 1). По ним можно определить частоту мочеиспускании, наличие императивных позывов, эпизодов неудержания и подтекания мочи, объемы выделенной мочи. Дневники микций являются простым и воспроизводимым методом объективизации жалоб, хотя они и могут изменять картину мочеиспускании пациента.
| день часы |
частота мочеиспускания |
дата объем мочеиспускания |
частота позывов, смена прокладок |
| День | |||
| 6-7 | |||
| 7-8 | |||
| 8-9 | |||
| 9- 10 | |||
| 10- 11 | |||
| 12- 13 | |||
| 13- 14 | |||
| 14- 15 | |||
| 15- 16 | |||
| 16 - 17 | |||
| 17 - 18 | |||
| 18 - 19 | |||
| 19 - 20 | |||
| 20- 21 | |||
| 21 - 22 | |||
| ночь | |||
| 22-6 |
| Рис. 1.
Дневник микций
|
Общий осмотр должен включать пальпацию живота, неврологический статус (нижние конечности и перинеальная область), гинекологическое обследование на предмет выявления опущения половых органов у женщин и пальцевое ректальное исследование у мужчин. Симптомы гиперактивного детрузора аналогичны таковым при наличии воспалительных изменений в мочевом пузыре. Клинический анализ мочи является обязательным и объективным скрининг-методом оценки наличия воспаления, посев мочи должен быть применен при более детальном обследовании. Определение объема остаточной мочи обоснованно у некоторых пациентов, в особенности пожилого возраста, при наличии симптомов нарушения мочеиспускания и/или рецидивирующей бактериурии, неврологических заболеваниях и подозрении на неэффективное опорожнение мочевого пузыря вследствие нарушения сократительной способности детрузора и/или инфравезикальной обструкции. Объем остаточной мочи можно определить с помощью трансабдоминального ультразвукового сканирования или катетеризацией мочевого пузыря. Большинству пациентов предварительный диагноз можно установить на основании данных анамнеза, анкеты, клинического анализа мочи и осмотра. После установления диагноза гиперактивный детрузор пациенту может быть эмпирически назначено лечение на период 2-3 месяца. Некоторым пациентам необходимо определение объема остаточной мочи. В некоторых случаях для установления диагноза необходимо проведение уродинамического исследования. Целью его является установление точного диагноза, например, наличия нестабильных сокращений при попытке пациента удерживать мочу или определение истинного недержания мочи (рис. 2),
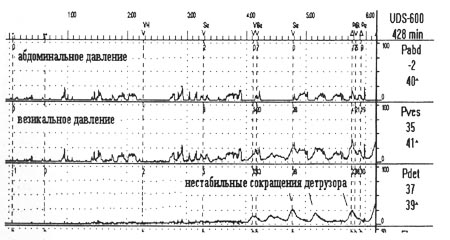 |
|
Рис.2.Цистометрограмма. Нестабильные сокращения детрузора |
Показаниями к уродинамическому исследованию являются: отсутствие эффекта от эмпирически назначенного лечения, планируемое хирургическое лечение недержания мочи при напряжении, наличие инфравезикальной обструкции у женщин, сопутствующее неврологическое заболевание.
Фармакотерапия гиперактивного детрузора.
Что касается лечения идиопатической гиперактивности детрузора, то оно подразделяется на:
1. Консервативное (общие рекомендации, гимнастика мышц тазового дна, изменение привычек, диета, "тренировка" мочевого пузыря, которая составляет не более 4%, ношение прокладок - 37%, фитотерапевтические препараты - 60%, физиотерапия).
2. Лекарственная терапия - 25% от всех видов лечения.
3. Хирургическое лечение.
Фармакотерапия гиперактивного детрузора должна быть рассмотрена в контексте спектра всех видов лечения данной нозологии. Но сочетание ее с другими видами консервативной терапии является оптимальным. Даже если предположить, что патогенез гиперактивности детрузора полностью неясен, то мишени действия препаратов могут находиться в центральной и периферической нервной системе.
Во время фазы накопления и хранения мочи в мочевом пузыре спинальные рефлексы активны на уровне везикальной эфферентной дуги. Эти рефлексы медиирут механизмы сокращения сфинктера уретры посредством соматических (поперечно-полосатых) и симпатических (гладкая мускулатура) нервов. К тому же симпатические нервы могут ингибировать сокращения детрузора. В нормальном состоянии во время наполнения не происходит активизации сакрального парасимпатического оттока (de Groat с соавт., 1993; de Groat, 1997). Мочеиспускание инициируется растяжением мочевого пузыря, которое активирует механорецепторы в его стенке. Это приводит к повышению активности малых миелинизирован-ных эфферентных нервов (А8), которые через ганглии дорсальных корешков достигают люмбосакрального отдела спинного мозга.
А8 афферентные нервы соединяются в спино-бульбоспинальную рефлекторную дугу, состоящую из восходящей петли люмбосакрального отдела спинного мозга, центра интеграции в клювовидном стволе мозга, известном как центр мочеиспускания моста (ЦММ), и нисходящей петли из ЦММ обратно к парасимпатическим ядрам в люмбосакральном отделе спинного мозга. Изменение афферентной активности может также проходить по малым немиели-низированным волокнам (С-волокна), идущим от детрузора и имеющим высокий порог механического раздражения, но которые активируются путем раздражения слизистой детрузора. С-волокна также могут быть активированы при спинномозговых травмах. Эфферентные пути рефлекса мочеиспускания достигают мочевого пузыря через тазовые нервы. Анатомически несколько центров в ЦНС могут быть вовлечены в контроль над рефлексом мочеиспускания: супраспинальные структуры, такие, как кора и диэнцефалон, средний мозг и мозжечок, а также спинальные структуры (de Groat с соавт., 1993). Несколько медиаторов вовлечены в процесс мочеиспускания и могут служить мишенью для фармакологических препаратов, контролирующих этот процесс.Было разработано несколько препаратов центрального механизма действия. В клинической практике применяются препараты, стимулирующие ГАМК рецепторы. Потенцирующий ингибирующий эффект на сокращения мочевого пузыря посредством опиатов широко известен, но в лечебной практике не применялся. Потенциально могут быть разработаны препараты, влияющие на ГАМК, опиоиды, норадреналин, допамин, но селективного воздействия на нижние мочевые пути добиться сложно.
Агонисты ГАМК-а- и ГАМК-Ь- рецепторов подавляют спинальные и супраспинальные компоненты рефлекса мочеиспускания, и поэтому есть основание верить тому, что в некоторых случаях путь супраспинального рефлекса мочеиспускания находится под тоническим ГАМК-эргическим ингибирующим контролем (de Groat с соавт., 1993).
Принято считать, что агонисты ГАМК-Ь, например баклофен, подавляют моносинаптические и полисинаптические мотонейроны и вставочные нейроны в спинном мозге. Этот препарат, миорелаксант центрального действия, использовался при нарушении мочеиспускания, включая вторичную гиперрефлексию детрузора при повреждении спинного мозга (Wein, 1995). Препарат также может быть альтернативой в лечении идиопатической гиперактивности детрузора (Taylor и Bates, 1979). Однако данные опубликованных исследований об этом препарате ограниченны.
Баклофен в капсулах может быть применен у пациентов со спастическим синдромом и дисфункцией мочевого пузыря и может увеличить его емкость (Kums и Delhaas, 1991, Steers с соавт., 1992, Bushman с соавт., 1991). В случаях гиперактивности детрузора терапевтические возможности нового поколения противоэпилептических препаратов, которые способны усиливать ГАМК-эргическую трансмиссию, к примеру, за счет ингибирования обратного усвоения ГАМК или ГАМК-трансаминазы (Perucca, 1996), необходимо тщательно исследовать.
Энкефалинергическое расширение наиболее выражено в областях спинальных парасимпатических ядер и ЦММ. Энкефалины эффективно подавляют мочеиспускание и рефлексы сфинктера путем стимуляции "|i", "5", "к"-рецепторов (de Groat с соавт., 1993). Достоверно известно, что морфин и другие опио-иды подавляют мочеиспускание и что данный эффект может быть блокирован налоксоном. Однако препараты, воздействующие на опиоидные рецепторы, вряд ли будут разрабатываться для лечения гиперактивности детрузора у людей.
Люмбосакральные симпатические и парасимпатические автономные так же, как и двигательные ядра сфинктера, получают массивный серотониновый импульс из рафаспинального пути. Препараты, взаимодействующие с серотонином или с серотониновыми рецепторами, никогда систематически не апробировались в качестве лечения гиперактивности детрузора у людей, пожалуй, кроме дулоксетина, ингибитора возврата серотонина и адреналина. Точно не установлено, что имипрамин, который помимо других эффектов блокирует возврат серотонина, подавляет гиперактивность детрузора именно посредством данного механизма (Maggi с соавт., 1989).
Симпатические, парасимпатические и соматические ядра в люмбосакральном отделе спинного мозга получают импульсы от норадренэргических нейронов в стволе мозга. Активация может осуществляться посредством бульбоспинальных норадренэргических путей с вовлечением в зону возбуждения альфа 1-адренорецепторов (de Groat с соавт., 1996). В эксперименте у нормальных крыс и крыс с наличием гипертрофии детрузора и инфравезикальной обструкции при проведении цистометрии доксазозин снижает микционное давление у животных обеих групп (Ishizuka с соавт., 1996). Эффект был еще более выражен у животных с гиперактивным детрузором. Доксазозин не снижает частоту и амплитуду нестабильных сокращений, выявленных у крыс с инфравезикальной обструкцией. Было высказано предположение, что доксазозин может воздействовать на уровне спинномозговых ганглиев, тем самым снижая активность парасимпатических нервов детрузора, и что этот эффект был более выражен у крыс с гипертрофией детрузора. Происходит или нет уменьшение выраженности симптомов, а также уменьшение выраженности гиперактивности детрузора при воздействии на спинальный или суп-распинальный отдел при действии al-адреноблокаторами у пациентов с ДГПЖ, еще предстоит установить (Andersson с соавт., 1997).
Известно, что у пациентов, страдающих болезнью Паркинсона, может иметь место гиперрефлексия детрузора, возможно, как следствие нигростриатального угнетения допамина и на рушения активации тормозящих D1 рецепторов (Yoshimura с со-авт., 1993). Однако другие допаминэргические системы могут активировать D2 рецепторы, усиливая рефлекс мочеиспускания. Sillen с соавт. (1981) показал, что апоморфин, который активирует D1 и D2 рецепторы, повышает гиперактивность детрузора у крыс под анестезией посредством стимуляции центральных допаминовых рецепторов.
Могут ли препараты, блокирующие допаминовые рецепторы, применяться для лечения гиперактивности детрузора, установлено не было.
Глутаматергические рецепторы, возможно, играют важную роль в возбуждении синапсов в нисходящем пути от ЦММ до спинальных парасимпатических ядер (de Groat с соавт., 1996). В эксперименте на взрослых крысах под анестезией ингибиторы рецепторов снижают амплитуду рефлекторных сокращений детрузора и задерживают мочеиспускание.
С другой стороны, у животных без анестезии антагонисты этих рецепторов снижают объем ответа рефлекторных сокращений детрузора и начала мочеиспускания. Потенциальная роль препаратов, действующих на глутаматэргические рецепторы и уменьшающих гиперактивность детрузора, нуждается в дальнейшем определении.Периферическая нервная система
Анатомическими мишенями для препаратов, применяемых для лечения гиперактивности детрузора, могут быть уретра, простата, ганглии или периферические нервы. Механизмами, на которые чаще всего направлено действие, являются рецепторы или ионные каналы, которые контролируют сокращения мочевого пузыря, например мускариновые рецепторы и кальциевые каналы 1-го типа (Andersson, 1997). Другие механизмы, участвующие в передаче нервного импульса или в возбуждении и сокращении гладкомышечных компонентов детрузора, также могут быть мишенями фармакологического воздействия.
Альфа-адреноблокаторы и бета-адреномиметики, блокаторы тахикининовых и ваниллоидных рецепторов, ингибиторы простаноидов, блокаторы кальциевых каналов, активаторы калиевых каналов и фосфодиэстеразы, теоретически являются значимыми путями для уменьшения гиперактивности или контрактильности мочевого пузыря. Было проведено большое количество исследований in vitro, однако ни один из препаратов с каким-либо из вышеуказанных механизмов действия не приводил к клиническому улучшению у пациентов с гиперактивностью детрузора.
Таким образом, единственными хорошо изученными препаратами, эффективными при лечении гиперактивности детрузора, оставались М-холиноблокаторы.
Фармакотерапия недержания мочи в России имеет свои особенности: М-холиноблокаторы, преимущественно оксибутинин, троспиум-хлорид и толтеродин, составляли всего лишь 2% от всей группы препаратов, в которую также входят нитрофураны (фурагин, 5-НОК), антибиотики (ампициллин, левомицетин, ниста-тин), спазмолитики (но-шпа), трициклические антидепрессанты, эстрогены, альфа-блокаторы и аналог антидиуретического гормона (адиуретин СД).
Andersson (2000), детально изучив работу мускариновых рецепторов, считает, что еще до конца не ясно, позволяют ли препараты, селективные к М-3 рецепторам, избежать тех побочных эффектов, которые компрометируют лечение. М-3 рецепторы имеются не только в мышце мочевого пузыря, но и в слюнных железах и в стенке кишечника. Поэтому антагонисты М-3 рецепторов являются причиной появления сухости во рту и запоров.
Превалирование побочных эффектов во время приема антимускариновых препаратов привело к созданию альтернативных форм или путей введения оксибутинина, наиболее часто назначаемого антимускаринового препарата, и разработке таких новых препаратов, как пропиверин, троспиум и толтеродин.
В НИИ урологии МЗ РФ проведено мультицентровое рандомизированное двойное слепое плацебоконтролируемое исследование оценки длительной переносимости троспиум-хлорида и оксибутинина. В исследовании участвовали 12 пациентов (2 - мужчины, 10 - женщины в возрасте от 18 до 75 лет) с симптомами императивного недержания, в сочетании с недержанием мочи при напряжении или изолированно или нейрогенной дисфункцией мочевого пузыря. Параллельные группы, не отличающиеся по демографическим и уродинамическим параметрам, после периода включения принимали троспиум-хлорид, 20 мг утром и оксибутинин, 5 мг или плацебо - вечером или косибутинин, 5 мг - утром и троспиум-хлорид, 20 мг или плацебо - вечером в течение 52 недель с уродинамическим инструментальным и лабораторным контролем и последующим периодом наблюдения в течение 4 недель. Уродинамические исследования после лечения выявили существенное увеличение максимальной цистометрической емкости и комплаэнтности, а также значительное снижение максимального давления детрузора при мочеиспускании в обеих группах, с определенной тенденцией к улучшению в группе пациентов, принимающих плацебо, по сравнению с группой, принимающих плацебо и исходными данными (р<0,001).
Побочные эффекты были типичными для антихолинергических препаратов. Однако процент пациентов, отметивших выраженную сухость во рту, был существенно ниже в группе пациентов, принимающих троспиум-хлорид, 20 мг два раза в день (4%), по сравнению с группой пациентов, принимающих оксибутинин 5 мг три раза в день. В группе больных, принимающих оксибутинин, 50% выбыло по причине непереносимости препарата, в то время как во второй группе все пациенты закончили исследование в определенный исследованием срок.
Исследование позволило сделать заключение, что прием троспиум-хлорида в дозе 20 мг два раза в день оказывает значимый эффект на уродинамические показатели гиперактивного детрузора по сравнению с плацебо и уменьшает симптомы заболевания. Препарат обладает более выраженным профилем эффективности и безопасности по сравнению с плацебо при лечении пациентов с гиперрефлексией детрузора. Эффективность дозы троспиум-хлорида в 20 мг, применяемой два раза в день, аналогична трехкратному приему 5 мг оксибутинина, но профиль побочных эффектов при этом менее выражен.
Другим исследованием, проведенным в НИИ урологии МЗ РФ, было плацебо контролируемое, рандомизированное двойное слепое трехнедельное клиническое исследование эффективности и переносимости троспиум-хлорида в дозе 40 и 80 мг в день в течение 3 недель у пациентов со сложной формой недержания мочи при напряжении в сочетании с моторным неудержанием, в котором участвовало 48 пациентов. Были подсчитаны средние значения изменения частоты мочеиспускания и максимальной емкости мочевого пузыря. В результате промежуточного анализа получены значительные статистические отличия (тренд р=0,0015). При сравнении параметра максимальной цистометрической емкости в группах пациентов, получавших троспиум-хлорид в дозировке 40 и 80 мг в день, отмечено абсолютное ее увеличение на 61 мл и 83 мл соответственно. Подобные изменения в виде уменьшения частоты мочеиспускания в два раза выше у пациентов, получавших троспиум-хлорид по сравнению с плацебо. Результаты внутригруппового анализа (групп пациентов только с моторным неудержанием, только сенсорным и группа со сложной формой недержания мочи при напряжении в сочетании с моторным неудержанием) показывают наилучшую эффективность троспиум-хлорида в группе со сложной формой недержания мочи при напряжении в сочетании с моторным неудержанием. Эффект от лечения в группах, получавших 40 и 80 мг троспиум-хлорида выра жавшийся в увеличении максимальной цистометрической емкости по сравнению с плацебо, составил +40,8 мл и +81,1 мл соответственно. Анализ безопасности применения троспиум-хлорида показал различия в трех группах по количеству побочных эффектов: группа плацебо - 50,
Для уменьшения побочных эффектов оксибутинина использовалось несколько новых препаратов: S-анантиомер (McCullough с соавт., 1997), ректальное и инфравезикальное введение (Collas и Maltwo-Lee, 1997, Osca-Garcia с соавт., 1997, 1997, Delaere и Branje, 1998) и конкурентное введение искусственной слюны (Arango-Toro с соавт., 1998). Оксибутинин с отсроченным высвобождением, таблетки по 5 и 10 мг разрешены к применению в США, но пока еще трудно оценить полученные данные, т.к. опубликовано несколько тезисов и нет данных по применению. Из опубликованных тезисов понятно, что препарат эффективен, но исследование не было плацебоконтролируемым (Gleason, 1998).
В письме производителей к фармацевтам обозначены следующие побочные эффекты: сухость во рту - 61%, запоры - 13%, сонливость - 12%, диарея - 9%. Побочные эффекты являются дозозависимыми: в тезисах дозировка точно не обозначена, но она была в пределах от 5 до 30 мг/день. Katz с соавторами (1998) исследовал нарушения когнитивной (опознавательной) функции у добровольцев пожилого возраста: оксибутинин вызывал значительное ее снижение в 7 из 15 исследований.
Пропиверин и троспиум-хлорид применялись в Европе. Существует несколько публикаций, касающихся этих соединений. Пропиверин теоретически имеет некоторые преимущества, и в двух недавно опубликованных тезисах описывается его безопасность и эффективность в отношении сердечно-сосудистой системы (Halaska с соавт., 1988, Voigt с соавт., 1988). Толтеродин является неселективным антагонистом мускариновых рецепторов, который проявил селективность в отношении мочевого пузыря по сравнению со слюнными железами в исследованиях in vitro и in vivo, у кошек и людей.
Rentzhog с соавторами (1998) опубликовали отчет о результатах II фазы исследования толтеродина, Appell (1997) детализирует анализ III фазы исследования толтеродина. Другие клинические исследования толтеродина подтверждают эти данные, которые показали, что он обладает более выраженным профилем переносимости по сравнению с оксибутинином. Они также выявили равную эффективность (при приеме толтеродина в дозе 2 мг 2 раза в день против 5 мг оксибутинина). Отдаленные результаты, представленные Drutz с соавт., 1998, показали, что 70% пациентов продолжали принимать толтеродин 9 месяцев и больше. Не существует сравнительных данных применения оксибутинина, хотя Kelleher с соавт. (1997) сообщили, что лишь 18% пациентов применяли атимускариновые препараты больше 6 месяцев (в основном оксибутинин). Во II фазе исследований, проведенной в США (сравнение приема препарата в дозах 0,5, 1, 2 и 4 мг дважды в день) при применении дозы 2 мг дважды в день, было отмечено наилучшее соотношение эффективности и побочных эффектов.
В III фазе сравнительных исследований эффективность оксибутинина была сравнима с толтеродином, но переносимость последнего была выше. Это подтвердилось приемом препарата в более низкой дозе и меньшим количеством пациентов, прекративших лечение, а также меньшим количеством и тяжестью проявления побочных эффектов, характерных для антимускариновых препаратов. Все последующие опубликованные работы и тезисы, касающиеся толтеродина, свидетельствуют о его эффективности, подтвержденной и уродинамически (Jtwos, 1997; Abrams, 1998; Chancellor, 2000).
Программа исследований по толтеродину была наиболее всеобъемлющей из всех, когда-либо проводимых по изучению фармакологической коррекции гиперактивности детрузора.
За период с 1997 г. и по настоящее время в НИИ урологии МЗ РФ проведено три международных мультицентровых исследования, в которых участвовало 57 пациентов. И более ста пациентов, которые были обследованы в Центре по проблемам нарушения мочеиспускания НИИ урологии, получали консервативное лечение (толтеродин в качестве монотерапии и в комбинации с физиотерапевтическими методами).
Оперативные методы лечения, которые подробно в данном обзоре не рассматриваются, применяющиеся при неэффективности или в сочетании с консервативной терапией, следующие:
1. Гидрорастяжение мочевого пузыря;
2. Подслизистое введение объемных агентов (коллаген);
3. Селективный крестцовый крионейролиз;
4. "Брахитерапия" - стимуляция крестцовых нервов изотопами радия;
5. Миоэктомия (аутоувеличение) детрузора;
6. Илиоцистопластика.
Данные методы направлены на улучшение качества жизни пациента, однако каждый из них имеет свои осложнения.
Разработка и улучшение этих методов позволят повысить процент успешных оперативных вмешательств и надеяться на решение проблемы гиперактивного детрузора в будущем.
Недавние исследования фармакотерапии гиперактивного детрузора касались либо новых форм, либо новых методов введения оксибутинина, а также нового препарата - толтеродина.
Толтеродин является многообещающим, имеющим эквивалентную эффективность и лучшую переносимость, чем оксибутинин, при применении его в таблетках дважды в день.
Необходимы дальнейшие наблюдения для подтверждения эффективности оксибутинина замедленного высвобождения.
Опубликованные данные показывают, что препарат достаточно эффективен, но существует необходимость в публикациях данных плацебоконтролируемых, сравнительных исследований, а также длительных исследований, подтверждающих его эффективность и переносимость у пациентов с гиперактивным детрузором при применении свыше 12 недель.
Помощь пациентам окажется более адекватной, если для лечения гиперактивного детрузора будут представлены несколько препаратов, обладающих хорошим профилем эффективности и переносимости при возможности различных форм введения. И, конечно, необходимы дальнейшие исследования для определения влияния данных препаратов на когнитивную функцию.


Комментарии
кричевский александр 2012.11.19 18:57
Смотреть все комментарии - 1
Ваш комментарий