Методы эфферентной хирургии крови и перспективы их применения в дерматологии
Методы гемокоррекции берут свое начало с древнейших времен.
Сегодня существуют немало различных методов экстракорпоральной гемокоррекции (ЭГК), позволяющих воздействовать как на гуморальные факторы, так и на клетки крови. Каждый из них имеет свои показания в лечении дерматозов. Рассмотрим подробнее эти методы лечения.
В целом все методы хирургии крови можно подразделить на методы, воздействующие на состав плазмы и на клетки крови. Исключением является самый древний способ гемокоррекции — кровопускание.
Кровопускание уже давно не имеет столь широких показаний, как это было много лет назад. Особенно популярным кровопускание было в XIII–XIX вв. в арабской и греческой медицине, и к нему относились почти как к панацее. С развитием медицины как науки популярность этого метода существенно ослабела. Тем не менее, в лечении поздней кожной порфирии этот метод и сегодня является ведущим.
Методы гемокоррекции с воздействием на состав плазмы
Плазмаферез (ПА) (от греч. plasma — плазма, apheresis — отнимание, удаление) — самый старый метод ЭГК после кровопускания. При этом плазма крови выбрасывается, а клетки крови возвращаются хозяину. Плазма замещается растворами электролитов, альбумина и донорской плазмой. ПА позволяет удалять вместе с цельной плазмой все патологические вещества, находящиеся в ней, такие как аутоантитела, циркулирующие иммунные комплексы (ЦИК), некоторые длительно живущие цитокины, как например фактор некроза опухолей альфа (ФНО-альфа), альфа-интерферон (альфа-ИФН), и др. Поэтому ПА эффективен, когда в основе заболевания лежит аутоиммунное заболевание с преобладанием хелперов второго типа, где происходит усиленная выработка аутоантител и формирование иммунных комплексов. ПА весьма эффективен, когда имеет место высокое содержание липидов. В дерматологии ПА используется прежде всего в лечении тяжелых аутоиммунных пузырных дерматозов [1].
ПА может проводиться либо дискретным, либо аппаратным способом. Дискретный способ исторически является самым старым и проводится путем центрифугирования цельной крови, собранной в специальные резервуары. Затем плазма отделяется от клеток крови, которые возвращаются пациенту, а плазма, в свою очередь, утилизируется. При аппаратном ПА кровь циркулирует в экстракорпоральном контуре. Отделение плазмы от клеток происходит либо центрифужным, либо фильтрационным способом в автоматическом режиме.
Эфферентные методы хирургии крови — относительно безопасные процедуры. Легкие побочные реакции, такие как кратковременная гипотензия, недомогание и повышение температуры, наблюдаются в 10–20% случаев. Тяжелые осложнения, как например, цитратная интоксикация, инфекция, тромбоз пунктируемой вены, анафилаксия, отек легких и сердечная аритмия, наблюдаются крайне редко. Необходимо отметить, что при тяжелых аутоиммунных заболеваниях ПА не может проводиться изолированно от иммуносупрессивной терапии и частота проведения и количество процедур имеют значение для эффективности лечения. Синдром отмены, т. е. увеличение титра аутоантител после их удаления, объясняется их пассивным выходом из межтканевых пространств в сосудистое русло. Через 3 часа после процедуры ПА может произойти возврат примерно 50% удаленных антител. Такое явление может быть компенсировано проведением относительно частых процедур: например, пять процедур в течение 7–8 дней. Особое беспокойство вызывает активная выработка новых аутоантител В?лимфоцитами в ответ на быстрое удаление иммуноглобулинов. Пик такой реакции может наблюдаться через две недели после окончания ПА, и уровень антител может быть существенно выше, чем был до начала лечения. Для преодоления этого феномена были выработаны различные стратегии. Ранее считали, что назначение высоких доз кортикостероидов дает лучший эффект, чем назначение других иммунодепрессантов. Однако последние исследования показали, что наиболее важный фактор — это время назначения иммунодепрессантов: их действие наиболее эффективно, если они назначаются немедленно после окончания терапии. Некоторые авторы считают, что методом выбора является пульс-терапия циклофосфамидом внутривенно. Если это не помогает или такое лечение неприемлемо ввиду его высокой токсичности, можно использовать другие лекарства, как, например, пульс-терапия метилпреднизолоном, метотрексат внутривенно, азатиоприн или микофенолата мофетил внутрь. Ретроспективные исследования показали, что только очень интенсивные курсы ПА с агрессивной иммуносупрессивной терапией могут быть эффективны. Поэтому ПА показан пациентам, больным пузырчаткой, у которых нет эффекта от кортикостероидов в дозе 2 мг/кг в сутки, с использованием дополнительных иммуносупрессантов или без них [2].
Но наряду с высокой эффективностью ПА при ряде заболеваний, имеются и очень нежелательные явления. Основные из них: вместе с удалением патологических веществ удаляются и вещества, которые препятствуют развитию заболевания; необходимость возмещения объема плазмы большими объемами альбумина или донорской плазмы от разных доноров может повлечь за собой ряд осложнений.
Именно наличие этих нежелательных условий проведения ПА заставило искать новые, более эффективные и безопасные способы эфферентного лечения.
Со временем такие способы появились и начали успешно развиваться. Новые, более сложные модификации ПА направлены на то, чтобы более избирательно удалять именно те вещества из плазмы крови, которые поддерживают развитие патологического процесса. Эти методы ЭГК более физиологичны, поскольку значительная часть собственной плазмы с большинством содержащихся в ней полезных веществ возвращается пациенту. По степени избирательности эти процедуры делятся на селективные и полуселективные.
Одним из таких методов является иммуносорбция, или иммунаферез (ИС). ИС относится к селективным методам и позволяет избирательно удалять только один целевой компонент. Концентрация всех остальных компонентов крови — клеток, ферментов, гормонов, белков и других веществ не меняется. Суть ИС состоит в том, что после получения плазмы она проходит через колонку, которая содержит иммуносорбент. Иммуносорбент представляет из себя какую-нибудь синтетическую основу (например, гелевые шарики) с фиксированными на ее поверхности антителами, имеющими тропность к определенному типу молекул, с которыми осуществляется аффинное взаимодействие. Таким способом можно избирательно удалять из крови липопротеиды низкой плотности (ЛПНП), липопротеид-А (ЛпА), иммуноглобулины IgG, IgM, ЦИК. В настоящее время используются различные системы и протоколы ИС. Этот метод доказал свою эффективность при тяжелых аутоиммунных антителозависимых заболеваниях. Специфические антитела пузырчатки удаляются примерно на 75% в течение одной процедуры ИС при использовании многоразовых систем. Интересно, что из-за повторной диффузии из тканей и, в меньшей степени, в связи с новой продукцией аутоантител, их уровень снова увеличивается до 40% первоначального значения на следующий день. Когда ИС используются три дня подряд (один цикл), уровень аутоантител сокращается на 95% по сравнению с первоначальным уровнем. Для изучения эффективности и побочных эффектов ИС при пузырчатке было начато и в настоящее время продолжается проспективное контролируемое многоцентровое исследование при поддержке программы «Клинические исследования» Немецкого научно-исследовательского cообщества (DFG). В исследовании принимают участие 25 клинических центров и сравниваются «лучшие методы лечения» вульгарной пузырчатки: преднизолон 1,0 мг/кг в день плюс азатиоприн (1,5–2,5 мг/кг в день) или микофенолата мофетил (2 г/сут) в случае непереносимости азатиоприна, с таким же лечением в сочетании с ИС. ИС выполняется в течение четырех дней ежедневно, а затем второй цикл — через 22–24 дня. В зависимости от клинического ответа могут быть проведены два дополнительных цикла с 3?недельными интервалами. Первичной конечной целью, поставленной для лечения, является время клинической ремиссии, определяемое как полное заживление пузырей и эрозий. Вторичные конечные показатели включают продолжительность клинической ремиссии, число больных в стадии ремиссии и другие клинические показатели. Это исследование планируется закончить в 2013 году, и оно, безусловно, поможет понять потенциал ИС в лечении пузырчатки и определить наиболее эффективную схему лечения. ИС была также успешно использована у пациентов с рефрактерным течением других аутоиммунных буллезных дерматозов. При приобретенном буллезном эпидермолизе ИС проводилась у четырех пациентов, двое из которых — с воспалительным и двое — с механобуллезным вариантом заболевания. В одном случае ремиссия была достигнута после 37 процедур ИС в сочетании с азатиоприном и снижающейся дозы преднизолона в течение 26 месяцев. Другому пациенту оказалось достаточно семь циклов ИС в сочетании с азатиоприном и преднизолоном и дополнительным введением ритуксимаба (препарат рекомбинантных антител против основной клеточной детерминанты В-лимфоцитов). В подгруппе механобуллезного варианта этого заболевания у одного пациента частичная ремиссия наблюдалась после двух курсов ИС в сочетании с ритуксимабом и микофенолата мофетилом, в то время как у других пациентов лечение позволило остановить прогрессирование заболевания [3].
ИС с успехом применяется также у больных с тяжелым течением атопического дерматита (АтД) и высоким уровнем общего сывороточного IgЕ. Совсем недавно было исследовано влияние ИС у 12 пациентов с очень высоким уровнем сывороточного IgE (> 4500 кЕ/л), которые не реагировали на лечение местными кортикостероидами и/или ингибиторами кальциневрина, ультрафиолетовыми лучами, системными кортикостероидами и циклоспорином A. Существенное и продолжительное клиническое улучшение, доказанное с помощью трех различных индексов (SCORAD, EASI и определение интенсивности зуда в баллах), было достигнуто после двух пятидневных курсов ИС (на первой и пятой неделях лечения). Следует отметить, что наблюдалось лишь краткосрочное снижение сывороточного IgЕ, с последующим быстрым восстановлением в течение трех недель после отмены ИС. В то же время уровень связанного IgЕ в дерме и эпидермисе был снижен до конца периода наблюдения (13 недель) уже после первого курса ИС. Параллельно отмечалось снижение инфильтрации кожи воспалительными клетками. К сожалению, у одного из пациентов лечение осложнилось сепсисом золотистого стафилококка, происходящего из центрального венозного катетера [3]. В будущем будут доступны системы, адсорбирующие специфические иммуноглобулины, как, например, антидесмоглеиновые антитела при вульгарной пузырчатке, цитоплазматические антиядерные антитела при системных васкулитах и др. Сегодня уже существуют сорбенты, которые избирательно адсорбируют IgЕ [2].
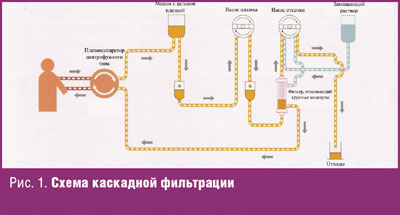
 Другим высокоэффективным современным методом является двойная, или каскадная, фильтрация плазмы (КФ). КФ — это полуселективная методика, которая позволяет удалять определенный спектр веществ из плазмы в зависимости от величины молекулы. Суть КФ состоит в том, что после получения плазмы она проходит специальный фильтр, мембрана которого имеет перфорационные отверстия определенной величины (рис. 1, 2). Молекулы, величина которых больше этих отверстий в мембране, не могут пройти через нее. Существуют фильтры с величиной пор 10, 20, 30 нм. Фильтр с величиной пор 30 нм позволяет удалять ЛПНП, ЛПОНП, IgM, ЦИК, вирусы, частично — фибриноген. Фильтр с величиной пор 10 нм позволяет удалять целый спектр веществ, образующихся в процессе аутоагрессии при аутоиммунных заболеваниях. Эта методика позволяет удалять аутоантитела и ЦИК почти столь же эффективно и избирательно, как более дорогой метод, ИС.
Другим высокоэффективным современным методом является двойная, или каскадная, фильтрация плазмы (КФ). КФ — это полуселективная методика, которая позволяет удалять определенный спектр веществ из плазмы в зависимости от величины молекулы. Суть КФ состоит в том, что после получения плазмы она проходит специальный фильтр, мембрана которого имеет перфорационные отверстия определенной величины (рис. 1, 2). Молекулы, величина которых больше этих отверстий в мембране, не могут пройти через нее. Существуют фильтры с величиной пор 10, 20, 30 нм. Фильтр с величиной пор 30 нм позволяет удалять ЛПНП, ЛПОНП, IgM, ЦИК, вирусы, частично — фибриноген. Фильтр с величиной пор 10 нм позволяет удалять целый спектр веществ, образующихся в процессе аутоагрессии при аутоиммунных заболеваниях. Эта методика позволяет удалять аутоантитела и ЦИК почти столь же эффективно и избирательно, как более дорогой метод, ИС.
Известно, что в патогенезе буллезного пемфигоида (БП), кроме аутоантител против антигенов БП, находящихся в прозрачной пластинке базальной мембраны, участвуют различные цитокины и хемокины. Hatano Y. et al. использовали полуколичественную полимеразную цепную реакцию (ПЦР) обратной транскрипции для исследования различных цитокинов и хемокинов в свежевыделенных мононуклеарных клетках периферической крови у пациентов с БП до и после четырех процедур КФ. К исследуемым цитокинам относились интерлейкин (ИЛ) ИЛ-2, ИЛ-4, ИЛ-5, ИЛ-8, воспалительный белок макрофагов (MIP) 1 альфа, ФНО и ИФН-гамма. В результате исследования было выявлено, что относительные уровни транскриптов для этих цитокинов были ниже в конце каждой процедуры КФ и после четырех процедур, чем в начале лечения. Во время обострения заболевания ИЛ-2, ИЛ-8, ИФН-гамма и ФНО были значительно выше, чем перед началом лечения, в то время как ИЛ-4 и ИЛ-5 оставались на более низком уровне. Наблюдения показывают, что во время КФ не только удаляются аутоиммунные антитела, но и происходят изменения выработки провоспалительных цитокинов мононуклеарными клетками. Нормализация их уровня может способствовать терапевтическому эффекту КФ при БП [4]. В то же время следует обратить внимание, что при аутоиммунных заболеваниях с преобладанием лимфоцитов-хелперов первого типа, как, например, псориаз или красная волчанка, возможен синдром отмены, при отсутствии соответствующей иммуносупрессивной терапии после окончания курса КФ. Механизм воздействия КФ на способность выработки цитокинов остается пока загадкой. Положительные результаты КФ в лечении БП представлены и в других публикациях, при этом без заметных побочных эффектов. Однако этот аутоиммунный буллезный дерматоз обычно протекает намного мягче, чем вульгарная пузырчатка, и имеет благоприятный прогноз, несмотря на длительное течение. Поэтому КФ и другие модификации ПА стоит иметь в виду в качестве опции для лечения пациентов с БП тогда, когда заболевание не реагирует на обычную стероидную терапию, и для тех, кому необходимо сократить или прекратить кортикостероиды из-за осложнений, таких как сахарный диабет (СД) и/или остеопороз [5].
Эффективность ПА в лечении токсического эпидермального некролиза, индуцированного лекарствами (синдром Лайелла), составляет 82,6%. Вероятно, некоторые виды некролитических факторов удаляются с помощью ПА [6]. ПА и, в частности, КФ могут оказаться эффективными, когда другие методы лечения не дают эффекта. Такое лечение снижает летальность от этого опасного заболевания. Японские авторы отмечают, что летальность от синдрома Лайелла составляет 17,4% при использовании КФ, в то время как в целом она до сих пор составляет около 40% [7].
Другое применение КФ — обострение тяжелого АтД с высоким содержанием IgЕ и лечение синдрома Job (синдром гипериммуноглобулинемии Е). Наряду с удалением избыточного IgЕ было обнаружено, что улучшался хемотаксис в результате устранения или снижения ингибитора хемотаксиса в сыворотке при использовании КФ [7].
Криоплазмосорбция (КПС), или криоаферез, — еще одна полуселективная модификация ПА. Методика КПС связана со свойством осаждения некоторых биологических веществ под воздействием низкой температуры в присутствии гепарина. Несмотря на то, что метод был разработан для лечения гиперхолестеринемии, эта процедура, помимо осаждения ЛПНП и ЛПОНП, также позволяет осаждать из плазмы ЦИК, иммуноглобулины, криоглобулины, фибронектин, фибриноген, способствует снижению коагуляционной активности крови и осаждает белки комплемента, уменьшая, таким образом, возможность воспалительных реакций и вязкость крови. Основными показаниями к проведению КПС являются заболевания, связанные с нарушениями микроциркуляции, такие как острая нейросенсорная тугоухость, диабетическая ангиопатия и ее проявления (ретинопатия, нефропатия, диабетическая стопа), возрастная макулодистрофия, ишемическая невропатия зрительного нерва, тромбозы артерий.
В мире широко применяется разновидность КПС, которая получила название HELP-apheresis (полное название — Heparin-induced extra-corporeal LDL precipitation apheresis treatments, т. е. экстракорпоральная гепарин-индуцированная преципитационная эфферрентная терапия ЛПНП). Отличие ее от КПС состоит в том, что осаждение определенного спектра веществ из плазмы происходит не при низкой температуре, а при увеличении кислотности плазмы в присутствии гепарина. Затем pH плазмы восстанавливается буферным раствором, остатки гепарина удаляются адсорбером, а очищенная плазма возвращается пациенту. Все эти процессы осуществляются непрерывно в замкнутом контуре аппарата. Такая модификация позволяет обрабатывать большой объем плазмы в ходе одной процедуры (1–1,5 ОЦП (объема циркулирующей плазмы)). F. van Buuren et al. провели ретроспективное исследование более чем восьми с половиной тысяч таких процедур. Менее чем у 3% пациентов наблюдались побочные реакции: головные боли, снижение артериального давления (АД), боли в груди и животе. Серьезных осложнений HELP-apheresis не было [8]. В связи со свойствами КПС и HELP-apheresis удалять иммунологические продукты и улучшать реологические свойства крови, процедура может быть использована в лечении болезней иммунных комплексов (красная волчанка и другие коллагенозы, системные и кожные васкулиты). Методы лечения КПС, HELP-apheresis, КФ, как уже говорилось, оказывают выраженный микроциркуляторный и реологический эффект путем уменьшения вязкости, свертывающей активности крови, восстановления эндотелий-зависимой вазодилатации, мембран эритроцитов и тромбоцитов. Поэтому все эти методики еще называют реоферезом (rheopheresis). Выраженный микроциркуляторный и реологический эффект также способствует скорейшему купированию воспаления при аутоиммунных заболеваниях, в том числе — и заболеваниях кожи.
Использование ПА при псориазе
ПА активно использовался для лечения псориаза в Советском Союзе с 80-х годов ХХ века и иногда до сих пор применяется в России. Научные публикации по использованию этого метода исходят почти исключительно из русскоязычных изданий. Как правило, в статьях отмечают стопроцентную эффективность метода, при отсутствии серьезных побочных эффектов [9, 10]. Исследование эффективности ПА проводили и в других странах. Так, например, шведские авторы опубликовали результаты двойного слепого контролируемого исследования у шести пациентов с продолжительным, средней тяжести монетовидным псориазом. Пациенты получали ПА или имитацию ПА один раз в неделю в течение 7 недель. При этом не было выявлено различий между активным лечением и плацебо. Авторы сделали вывод, что нет смысла проводить более крупные исследования в отношении псориаза ввиду слабого эффекта и высокой стоимости ПА [11]. Позднее отношение к ПА как методу лечения псориаза изменилось и в России. В. В. Ручков и соавт. проводили ретроспективное исследование 124 историй болезни пациентов с псориатической болезнью в прогрессирующей стадии, у которых был использован аппаратный мембранно-фильтрационный ПА. Авторы пришли к выводу, что использование ПА патогенетически обосновано у больных псориазом в острой стадии заболевания, PASI (Psoriasis Area and Severity Index — индекс площади и тяжести псориаза) которых более 18 баллов. ПА, по мнению авторов исследования, позволял быстрее и легче достигать ремиссии [12].
8 пациентов с псориазом, все с выраженным шелушением и 7 — с инвалидизирующим псориатическим артритом, проходили лечение методом КФ, начиная с трех процедур в неделю в течение двух недель, затем один раз в неделю, всего десять процедур. Шесть из 7 пациентов (86%) с артропатией и 3 из 8 пациентов (38%) с вульгарным псориазом имели положительный эффект от лечения. Было значительное падение уровня ЦИК в связи с лечением, и за удалением ЦИК последовало снижение активности воспаления кожи и суставов. Однако не было никакой корреляции между уровнем ЦИК, активностью заболевания или ответом на лечение. В связи с результатами исследования авторы пришли к выводу, что ЦИК может играть значительную роль в отношении псориатического артрита, но не при вульгарном псориазе, и ПА может быть полезен у пациентов, которые не реагируют на традиционную терапию [13].
В целом стоит отметить, что при тех заболеваниях, где ведущую роль играет клеточный и местный, а не гуморальный иммунитет, как, например, псориаз, или повышенная чувствительность рецепторов гормонов и «заставоподобных» рецепторов (toll-like receptors) (как при угревой болезни), вряд ли можно ожидать удовлетворительных результатов от применения различных модификаций ПА. Тем не менее, с помощью них удаляются некоторые растворенные в плазме вещества, влияющие на развитие болезни. Хотя эти вещества находятся в основном в ничтожно малых количествах, их удаление с помощью ПА может быть полезно при обострении псориаза, особенно при псориатической эритродермии и артропатическом псориазе. Однако следует иметь в виду, что усиление хемотаксиса, как одно из свойств ПА, может иметь негативное воздействие при экссудативном и особенно пустуллезном псориазе, где именно за счет усиления хемотаксиса в патологические очаги привлекаются нейтрофильные гранулоциты.
Методы гемокоррекции с воздействием на клетки крови
Удаление из сосудистого русла клеток крови называется цитаферезом. Цитаферез успешно применяется при ревматоидном артрите (РА), системной красной волчанке (СКВ), аутоиммунных воспалительных заболеваниях кишечника [14, 15]. Использование цитафереза в дерматологии будет также рассмотрено в данной статье. Сегодня есть возможность изолировать из кровяного русла избирательно любой тип клеток, либо с целью донорства, либо — с терапевтической целью. В зависимости от типа удаляемых клеток процедура называется гранулоцитаферез, лимфоцитаферез, моноцитаферез, тромбоцитаферез, эритроцитаферез и т. д.
Эффект тромбоцитафереза (ТрА) при лечении бронхиальной астмы (БА) отмечался только в немногочисленных публикациях русскоязычной научной литературы [16, 17]. Авторы отмечают нормализацию морфологических характеристик тромбоцитов и хороший эффект от лечения. Эффективность данного метода, возможно, объясняется улучшением реологических свойств крови и тем, что фактор роста тромбоцитов — один из биологически активных веществ, участвующих в аллергических реакциях. Один из авторов данной статьи наблюдал быстрый и стойкий терапевтический эффект у больных тяжелой БА. Однако в полной мере механизм воздействия этого метода неясен. Логично было бы предположить, что ТрА может быть полезен при лечении АтД или крапивницы, однако публикаций на эту тему мы не обнаружили.
Гранулоцит- и моноцитаферез (ГМА) — это метод ЭГК, который удаляет активированные гранулоциты и моноциты. ГМА был первоначально утвержден как метод лечения язвенного колита, поскольку при этом заболевании активированные гранулоциты и макрофаги проникают в ткани-мишени. Пустулезный псориаз тоже связан с воздействием активированных нейтрофилов. Был опубликован ряд наблюдений лечения генерализованного пустулезного псориаза с помощью ГМА. Нередко пациенты имели такую тяжелую сопутствующую патологию, как цирроз печени или СКВ. Авторы публикаций отмечают отсутствие серьезных побочных эффектов и хороший терапевтический эффект ГМА [18, 19].
Liumbruno G. M. et al. сообщают о проспективном исследовании лечения пяти пациентов, больных псориазом, с использованием лимфоцитафереза (ЛфА). У всех пациентов наблюдалось улучшение поражения кожи и, соответственно, индекса PASI. Никаких побочных эффектов, связанных с аферезом, не отмечалось. ЛфА, как считают авторы, дают хорошие результаты и при вульгарной пузырчатке [20].
ГМА полезен в лечении гангренозной пиодермии. Это лечение может быть эффективным также и для лечения других заболеваний, связанных с активированными гранулоцитами. В частности, изучалась эффективность ГМА у четырех больных с псориатическим артритом. Лечение привело к значительному снижению интенсивности боли в суставах [21].
Экстракорпоральный фотоферез (ЭКФ) — это метод ПУВА-терапии клеток крови, где клетки крови облучаются вне организма человека ультрафиолетовыми лучами спектра А (УФО спектра А) в присутствии фотосенсибилизатора (обычно — 8-метоксипсорален (8-МОП), псорален), который вводится либо непосредственно в облучаемую кровь экстракорпорально, либо после приема этого препарата внутрь. Эти фотосенсибилизирующие химические вещества в отсутствие УФО встраиваются в ДНК. Под воздействием УФО спектра А они образуют соединения с пиримидиновыми основаниями в ДНК, сшивая таким образом псорален между парными нитями ДНК. Это приводит к сокращению жизнеспособности клеток, а также позитивно регулирует производство определенных цитокинов. Таким образом, эффективность ЭКФ при различных заболеваниях может зависеть от его способности подавлять функцию клеток или — рост и дифференцировку клеток. ЭКФ был разработан для лечения пациентов с первичной Т-клеточной лимфомой кожи (ТКЛК) и показал хорошую эффективность в США и ряде европейских стран. В дальнейшем использование ЭКФ показало обнадеживающие результаты в лечении системной склеродермии и реакции отторжения трансплантата (РОТ). Существует несколько теорий, выдвинутых, чтобы объяснить механизм действия ЭКФ. Среди них — продукция антиидиотипических антител и развитие клона специфических антиидиотипических T-супрессоров после реинфузии лейкоцитов, которые подвергались ЭКФ. Было обнаружено увеличение числа клеток, подвергшихся апоптозу через сутки после воздействия ЭКФ, тогда как в интактных клетках периферической крови этих же пациентов не было таких отличий. Вполне возможно, индукция апоптоза обусловлена тем, что лимфоциты подвергаются изменению их функционального потенциала и экспрессии мембранных молекул [22]. Однако немногие исследователи прослеживали эффект ЭКФ на моноциты более чем в течение 24 ч после их обработки. Было замечено, что незрелые дендритные клетки, трансформированные из моноцитов, а также из периферической крови, подвергались апоптозу в результате ЭКФ, также как и лимфоциты, в течение 72 ч, большинство из них — даже раньше. Основной вопрос заключается в том, как функционируют моноциты/дендритные клетки, возвращенные пациенту после ЭКФ? Одним из объяснений эффекта ЭКФ является то, что ЭКФ вызывает цитолитический иммунитет непосредственно против клональных опухолевых клеток. Тем не менее, такая же реакция наблюдалась в отношении клеток ТКЛК, не имеющих клонального признака. Один из основных вопросов в лечении ТКЛК: способствует ли ЭКФ индукции специфической цитотоксичности в клетках лимфомы или индукции специфических или неспецифических регуляторных Т-клеток, контролирующих ТКЛК? Объяснение эффективности ЭКФ в лечении злокачественных заболеваний не может объяснить причины эффективности этого метода при РОТ и аутоиммунных заболеваниях. Недавно были рассмотрены несколько потенциальных механизмов действия ЭКФ при РОТ, в том числе стимуляция или подавление продукции цитокинов, подавление активированных Т-клеток или индукция регуляторных Т-клеток [23]. Обработка клеток псораленом и УФО модулирует продукцию цитокинов. Tokura Y. et al. определяли количественно ИЛ-8 как представителя хемокинов, продуцирумых моноцитами, в культуральной жидкости с мононуклеарными клетками периферической крови (МПК) человека, обработанными 8-ОП и УФО спектра А. Клетки, прошедшие процедуру фотофереза, более эффективно вырабатывали ИЛ-8 после стимуляции их липополисахаридом in vitro, чем необработанные или обработанные только 8-ОП или только УФО спектра А. Увеличение производства цитокинов/хемокинов моноцитами после ЭКФ может быть одним из механизмов, лежащих в основе терапевтической эффективности экстракорпоральной фотохимиотерапии в лечении ТКЛК. Известно, что ЭКФ индуцирует дифференциацию моноцитов в антиген-представляющие дендритные клетки. Продукция ИЛ-8 может способствовать CD8+ Т-клеткам концентрироваться вокруг опухолевых лимфоцитов, предоставляя антиген дендритным клеткам, в которые дифференцируются моноциты. Это приводит к активации противоопухолевых Т-клеток и обеспечивает эффективность терапии [24]. Однако много вопросов в отношении механизма действия ЭКФ еще предстоит прояснить.
Есть также доказательства, подтверждающие успешное использование ЭКФ в предотвращении отторжения сердца после трансплантации. Британские исследователи пришли к заключению о нецелесообразности использования этого метода в лечении системной склеродермии и рассеянного склероза [25]. В то же время личный опыт авторов данной статьи говорит о том, что с помощью ЭКФ можно снимать обострение этих заболеваний посредством подавления аутоагрессивных клеток иммунной системы. Пока еще нет однозначного мнения в отношении этого вопроса [26], и поиск адекватных комбинаций с другими методами ЭГК и медикаментозной терапией может привести к усилению эффективности лечения системных коллагенозов.
G. Klosner et al. инкубировали лимфоциты периферической крови человека в присутствии антител к маркеру Т-лимфоцитов, CD3 и рекомбинантным человеческим ИЛ-2 и ИЛ-4 в течение 48 часов. После последующей стимуляции с ИЛ-2 и ИЛ-4 в течение 72 часов клетки обрабатывали 8-ОП, облучали УФО спектра А и инкубировали еще в течение 5 часов в специальной среде с активирующими компонентами. Авторы выявили снижение выработки ИЛ-2 и ИФН-гамма и увеличение продукции ИЛ-4, что указывает на изменение подавления хелперов первого и стимуляцию хелперов второго типа. Степень этих изменений зависела от концентрации 8-МОП [27]. Это может объяснять лечебный эффект ЭКФ при псориазе и РОТ.
Другое заболевание кожи, при котором ЭКФ может быть полезным, — это АтД. В открытое исследование были включены семь пациентов с тяжелым АтД (индекс оценки тяжести АтД — SCORAD > 45) длительностью не менее одного года, который в последние 12 месяцев был резистентен к лечению любым из трех методов лечения, относящихся к первой линии терапии для AтД: наружных стероидов, ингибиторов кальциневрина и одной из форм фототерапии или к одному из второй линии терапии (системные стероиды или циклоспорин). Лечение состояло из двух процедур ЭКФ два дня подряд каждые две недели в течение как минимум 12 недель, максимум до 20 недель. Проводилась оценка качества жизни с помощью опросника состояния здоровья (SF-36 Health Survey) и индекса функциональной оценки терапии хронических заболеваний (FACT-G). ЭКФ привел к значительному снижению индекса SCORAD: в среднем с 77,7 балла после 10 циклов индекс снизился до 55,6 балла. Пациенты сообщили, что они начали замечать улучшение состояния кожи после пяти циклов фотофереза. Оценка FACT-G показала значительное улучшение, с 64,8 до 72,9 (р < 0,05), и SF-36 Health Survey показал значительное улучшение эмоционального благополучия (р < 0,05) [28]. ЭКФ в лечении АД была исследована у другой ограниченной группы пациентов и оказалась эффективной при ЭКФ с 4-недельными интервалами. 2-недельные интервалы ЭКФ также привели к значительному улучшению состояния кожи. Однако высокий уровень общего IgE оказался предиктором отрицательного результата этого метода, что согласуется с результатами экспериментальных исследований G. Klosner et al. [29].
Учитывая, что ЭКФ приводит к активизации хелперов второго типа [28], можно предположить, что при АтД в стадии обострения ЭКФ может привести даже к утяжелению заболевания, зато он может быть полезен у больных АтД с хроническим, торпидным течением. Это связано с тем, что в стадии обострения АтД преобладает активность хелперов второго типа, а в хронической фазе — лимфоцитов-хелперов первого типа [30].
M. Di Renzo et al. исследовали воздействие лимфоцитов, подвергшихся ЭКФ, на культуру дендритных клеток. В результате исследования выяснилось, что при этом снижается экспрессия CD54 (ICAM-1), CD40 и CD86, что указывает на снижение функциональной активности дендритных клеток. Как известно, эти клетки играют важнейшую роль в развитии псориаза, и, значит, воздействуя на лимфоциты в крови, мы можем опосредованно подавлять функцию тканевых дендритных клеток, где бы они ни находились. В то же время, при совместном культивировании лимфоцитов после ЭКФ и дендритных клеток, повышалась продукция ИЛ-10, важнейшего противовоспалительного цитокина, тогда как продукция ИЛ-12 и ФНО осталась без изменений [31]. Эти результаты показывают, что ЭКФ можно использовать в лечении тяжелых форм псориаза как самостоятельно, так и в комбинации с биологическими препаратами, которые действуют на другие факторы болезни.
Заключение
В основном в научной литературе имеются публикации с малым числом наблюдений использования различных методов ЭГК. За редким исключением, это ретроспективные или проспективные контролируемые исследования, без исследования эффекта плацебо, что вполне объяснимо технической сложностью и высокой стоимостью эфферентных методов хирургии крови.
Тем не менее, эфферентная хирургия крови — это сильные методы лечения, которые могут быть использованы для пациентов с тяжелыми дерматозами. Следует учитывать патогенез заболевания и характер действия определенных методов гемокоррекции при выборе терапии. При этом методы ЭГК не могут использоваться как самостоятельный и единственный метод лечения того или иного дерматоза, а лишь как вспомогательная терапия, позволяющая сдвинуть тяжелое или торпидное к лечению заболевание в сторону ремиссии.
Комбинация различных методов ЭГК, основанная на знаниях патогенеза заболевания, может позволить значительно усилить эффект лечения, предотвратить развитие феномена отмены и уменьшить дозировки, а значит, и побочные эффекты лекарств, необходимых для лечения тяжелых заболеваний.
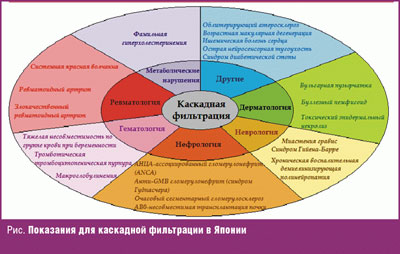
ПА и его модификации могут с успехом использоваться при аутоиммунных пузырных дерматозах, системных коллагенозах, васкулитах, синдроме Лайелла, АтД в стадии обострения (особенно с высоким уровнем IgЕ), синдроме Job, артропатическом псориазе. Несмотря на то, что ПА и его модификации — весьма дорогостоящие процедуры, в связи со своей высокой эффективностью при ряде заболеваний они оплачиваются медицинскими страховыми компаниями в некоторых странах и, в частности — в Японии (рис.), Германии, США. Рекомедации по применению различных методов гемокоррекции устанавливаются на принципах доказательной медицины. Список заболеваний довольно велик, многие из которых имеют рекомендации как метод первого выбора, с высокой степенью достоверности эффективности лечения [32].
КФ и КПС эффективно используются в лечении гиперхолестеринемии и, значит, могут помочь при ее проявлениях на коже — ксантомах. При васкулитах и диабетических васкулопатиях КФ и КПС также могут быть очень полезными.
ТрА может быть эффективен при обострении БА. Возможно, этот метод будет полезен при выраженном обострении АтД, однако пока нет доказательств этого предположения.
ГМА и ЛфА можно использовать для купирования обострения пустулезного псориаза, псориатического артрита, гангренозной пиодермии.
ЭКФ с успехом используется при эритродермической и других формах ТКЛК. Можно использовать ЭКФ для лечения псориатической эритродермии или упорном течении тяжелого вульгарного псориаза, РОТ, АтД с низким титром IgЕ. Целесообразность использования ЭКФ при системных коллагенозах остается пока дискутабельной.
Наверное, это не полный перечень возможных приложений эфферентных методов хирургии крови в дерматологии. Сами методики совершенствуются и по мере их развития становятся более эффективными и безопасными. И нередко эти методы не только помогают снять обострение, но и спасают жизнь пациента.
Литература
- Sagi L., Baum S., Gendelman V. et al. The role of therapeutic plasma exchange in pemphigus vulgaris // JEADV. 2011 (25): 82–86.
- Meurer M., Messer G. Plasmapheresis and Intravenous Immunoglobulins // Dermatol Ther. 2002 (15): 333–339.
- Meyersburg D., Schmidt E., Kasperkiewicz M., Zillikens D. Immunoadsorption in Dermatology // Ther Apher Dial. 2012; 16 (4): 311–320.
- Hatano Y., Katagiri K., Arakawa S. et al. Successful treatment by double-filtration plasmapheresis of a patient with bullous pemphigoid: effects in vivo on transcripts of several genes for chemokines and cytokines in peripheral blood mononuclear cells // Br J Dermatol. 2003 Mar; 148 (3): 573–9.
- Kitabata Y., Sakurane M., Orita H. et al. Double filtration plasmapheresis for the treatment of bullous pemphigoid: a three case report // Ther Apher. 2001 Dec; 5 (6): 484–490.
- Yamada H., Takamori K., Yaguchi H., Ogawa H. A study of the efficacy of plasmapheresis for the treatment of drug induced toxic epidermal necrolysis // Ther Apher. 1998 May; 2 (2): 153–156.
- Yamada H., Nagaoka I., Takamori K., Ogawa H. // Artif Organs. 1995 Jan; 19 (1): 98–102.
- Van Buuren F., Kreickmann S., Horstkotte D. et al. HELP apheresis in hypercholesterolemia and cardiovascular disease: efficacy and adverse events after 8,500 procedures // Clin Res Cardiol Suppl. 2012, June; 7 (Suppl 1): 24–30.
- Потекаев Н. С., Курдина М. И., Горшкова Н. Н. Оценка эффективности плазмафереза в терапии псориаза // Клиническая медицина. 1991, Март; 69 (3): 80–82.
- Потекаев Н. С., Курдина М. И., Горшкова Н. Н. и др. Плазмаферез в лечении торпидных форм псориаза // Вестн. дерматол. венерол. 1990; (10): 35–37.
- Clemmensen O. J., Andresen R., Andersen E. Plasmapheresis in the treatment of psoriasis. A controlled clinical study // J Am Acad Dermatol. 1983 Feb; 8 (2): 190–192.
- Ручков В. В., Гончар-Зайкин А. П., Воробейкина Н. А. Интенсивная терапия плазмаферезом в прогрессирующей стадии псориатической болезни // Военно-медицинский журнал. 2009, декабрь; 330 (12): 24–26.
- Jorstad S., Bergh K., Iversen O. J. et al. Effects of cascade apheresis in patients with psoriasis and psoriatic arthropathy // Blood Purif. 1998; 16 (1): 37–42.
- Liumbruno G. M., Centoni P. E., Molfettini P. et al. Lymphocytapheresis in the treatment of psoriasis vulgaris // J Clin Apher. 2006; 21: 158–164.
- Watanabe Y., Yamada H. Leukocyte adsorption apheresis for the treatment of pyoderma gangrenosum // J Dermatol. 2008; 35: 792–794.
- Татарский А. Р., Алиева К. М., Бурячковская Л. И. и др. Морфологические свойства крови тромбоцитов у больных бронхиальной астмой до и после тромбоцитафереза // Терапевтический архив. 1995; 67 (3): 39–40.
- Татарский А. Р., Эмирова А. С., Алиева К. М. и др. Отдаленные результаты лечения тромбоцитафереза у больных бронхиальной астмой // Терапевтический архив. 1993; 65 (3): 19–22.
- Shukuya R., Hasegawa T., Niwa Y. et al. Granulocyte and monocyte adsorption apheresis for generalized pustular psoriasis // J Dermatol. 2011 Dec; 38 (12): 1130–1134.
- Furusawa K., Hasegawa T., Ikeda S. Immunosuppressant and infliximab-resistant generalized pustular psoriasis successfully treated with granulocyte and monocyte adsorption apheresis // Ther Apher Dial. 2012, Aug; 16 (4): 379–380.
- Liumbruno G. M., Centoni P. E., Molfettini P. et al. Lymphocytapheresis in the treatment of psoriasis vulgaris // J Clin Apher. 2006; 21: 158–164.
- Kanekura T., Kawabata H., Maruyama I., Kanzaki T. Treatment of psoriatic arthritis with granulocyte and monocyte adsorption apheresis // J Am Acad Dermatol. 2004, Feb; 50 (2): 242–246.
- Enomoto D. N. H., Schellekens P. T. A., Yong S. et al. Extracorporeal photochemotherapy (photopheresis) induces apoptosis in lymphocytes: a possible mechanism of action of PUVA therapy // Photochem Photobiol. 1997; 65: 177–180.
- Rao V., Saunes M., Jorstad S., Moen T. In Vitro Experiments Demonstrate that Monocytes and Dendritic Cells are Rendered Apoptotic by Extracorporeal Photochemotherapy, but Exhibit Unaffected Surviving and Maturing Capacity after 30 Gy Gamma Irradiation // Scand J Immunol. 2008; 68: 645–651.
- Tokura Y., Seo N., Tomida M. et al. Augmentation of monocyte interleukin-8 production by psoralen/UVA-treated CD4+ T cells // Exp Dermatol. 2002; 11: 564–572.
- McKenna K. E., Whittaker S., Rhodes L. E. et al. Evidence-based practice of photopheresis 1987–2001: a report of a workshop of the British Photodermatology Group and the U. K. Skin Lymphoma Group // Br J Dermatol. 2006; 154: 7–20.
- «Extracorporeal photopheresis»: Medical Coverage Guidelines of the Blue Cross and Blue Shield Association of Arizona, 21/02/2012: 5 pages.
- Klosner G., Trautinger F., Knobler R., Neuner P. Treatment of Peripheral Blood Mononuclear Cells with 8-Methoxypsoralen plus Ultraviolet A Radiation Induces a Shift in Cytokine Expression from a Th1 to a Th2 Response // J Invest Dermatol. 2001; 116: 459–462.
- Bechara F. G., Radenhausen M., Tomi N. S. et al. Extracorporeal photopheresis as a treatment for patients with severe, refractory atopic dermatitis // Dermatology. 2007; 215 (2): 134–138.
- Grundmann S. A., Beissert S. Modern aspects of phototherapy for atopic dermatitis // J Allergy (Cairo. 2012; 2012: 121797.
- Leung D. Y., Jain N., Leo H. L. New concepts in the pathogenesis of atopic dermatitis // Curr Opin Immunol. 2003, Dec; 15 (6): 634–638.
- Di Renzo M., Sbano P., De Aloe G. et al. Extracorporeal photopheresis affects co-stimulatory molecule expression and interleukin-10 production by dendritic cells in graft-versus-host disease patients // Clin Exper Immunol. 2008; 151: 407–413.
- Szczepiorkowski Z. M., Winters J. L., Bandarenko N. et al. Guidelines on the Use of Therapeutic Apheresis in Clinical Practice-Evidence-Based Approach from the Apheresis Applications Committee of the American Society for Apheresis // J Clin Apher. 2010; 25: 83–177.
Ю. Г. Халиулин, кандидат медицинских наук, доцент
А. Г. Ольшанский
Я. М. Марголин
Медицинский центр «Петровские Ворота», Москва
www.lvrach.ru


Ваш комментарий