Структурно-функциональное состояние компонентов периферической крови у женщин с типичной формой генитального герпеса при проведении эндоваскулярного лазерного облучения крови
В.Н. Серов, С.Г. Цахилова, П.Д. Бонарцев, А.М. Абубакирова, Т.А. Федорова, Н.В. Орджоникидзе, Т.Г. Хлыстова, Э.М. Бакуридзе
Научный центр акушерства, гинекологии и перинатологии РАМН
(директор центра - академик РАМН, проф. В.И. Кулаков), Москва.
Вестник Российской Ассоциации Акушеров-Гинекологов № 1 '98
В настоящее время известен ряд хронических заболеваний влагалища и шейки матки, возникающих в результате инфицирования половых путей аденовирусами, цитомегаловирусом, Вирусами Коксаки A, ECHO и др. [15]. Но чаще всего гениталии поражаются вирусом простого герпеса (ВПГ). Эта инфекция представляет значительную проблему для репродуктивного здоровья населения, так как первичное инфицирование вирусом простого герпеса или рецидивы заболевания во время беременности могут привести к внутриутробной инфекции, вызывающей повреждения, после которых дальнейшее развитие плода становится невозможным или сопровождается тяжелыми осложнениями, а инфицирование во время родов может быть причиной тяжелых неонатальных и постнатальных заболеваний новорожденных [12, 16, 19, 20].
Вирус герпеса относится к ДНК-содержащим вирусам, имеет сложную структуру, вирионы диаметром 150-200 нм содержат протеин, спермин, глико- и липопротеиды. Вирус чувствителен к эфиру, фенолу, формалину, алкоголю, нагревание до 55о С разрушает его в течение 30 мин [1].
Вирус начинает размножаться в месте инокуляции, где появляются типичные пузырьковые высыпания, и проникает в кровяное русло. Установлено, что вирус может оседать в виде элементарных телец в эритроцитах, а также поражать лейкоциты, лимфоциты, макрофаги. Таким образом, вирусемия является одной из причин диссеминации вируса в организме, обусловливает интенсивность клинических проявлений болезни [1].
Выявлены два серотипа ВПГ: ВПГ-1 и ВПГ-2. По общепринятому мнению, ВПГ-2 отводится этиологическая роль при генитальных, а ВПГ-1 - при экстрагенитальных поражениях. Генитальный герпес - одно из наиболее распространенных заболеваний, передаваемых половым путем, занимающий второе место после трихомоноза [18]. Первичное инфицирование половой сферы происходит преимущественно в период начала активной половой жизни в возрасте 18-25 лет при контакте с партнером, страдающим генитальным герпесом. Второй пик заболеваемости у женщин в отличие от мужчин приходится на возраст 45 лет и старше [14]. Для генитального герпеса характерно тяжелое течение с частыми рецидивами болезни, нарушающими нормальную половую функцию пациента. Многие исследователи подчеркивают, что болезнь создает конфликтные ситуации в семье, является источником нервно-эмоциональных нарушений у больного, приобретая социальный характер. Предполагают, что 50-60% лиц в группе с низким уровнем жизни имеют антитела к ВПГ-2 к середине жизни, эти антитела обнаружены только у 10-20% лиц в группе с высоким уровнем жизни и у 35% женщин среднего класса [20].
Клинические проявления первичного герпеса наблюдаются обычно в течение 2-3 нед. Сроки возникновения рецидива варьируют, но у 50% больных они появляются в ближайшие 6 мес. При этом симптомы выражены слабее и менее продолжительны, чем при первичной инфекции (7-10 дней). При увеличении длительности заболевания и в связи с проводимым лечением клиническая картина может изменяться [19]. Характерным для патогенеза герпетической болезни является нарушение иммунного ответа [6, 8, 13, 17]. В противовирусной защите организма принимают участие факторы клеточного и гуморального иммунитета. Факторы клеточного иммунитета участвуют в подавлении репродукции вируса, в процессах миграции и удержании макрофагов, лимфоцитов в очаге воспаления. Кроме того, факторы клеточного иммунитета, с одной стороны, вызывают лизис инфицированных клеток и способствуют высвобождению внутриклеточного вируса для последующей нейтрализации его антителами, с другой - влияют на соседние нормальные клетки, предупреждая их инфицирование [4, 17].
Лечение больных с генитальным герпесом представляет собой сложную задачу. Оно должно быть комплексным, направленным на подавление репродукции вируса при одновременной стимуляции факторов специфической и неспецифической защиты организма. Одним из перспективных немедикаментозных методов лечения является фотогемотерапия, в частности эндоваскулярное лазерное облучение крови (ЭЛОК). Лечебный эффект достигается за счет воздействия лазерного излучения на форменные элементы крови, белковые структуры плазмы, антиоксидантную систему. В результате облучения крови отмечается активизация ферментов в эритроцитах, улучшение реологических показателей и снижение коагуляционных свойств крови, происходят изменения в иммунной системе, нормализуются процессы перекисного окисления липидов, энергетический баланс организма, отмечается бактерицидный эффект [7]. Все большее подтверждение находит концепция о едином потоке каскадных клеточных и ферментативных реакций, обеспечивающих взаимодействие указанных систем регуляции [10]. Электронная микроскопия дает уникальную возможность изучать одновременно функциональное состояние элементов систем гемостаза, иммунитета и неспецифической резистентности, их макромолекулярных комплексов, т. е. проводить многотестовое исследование компонентов крови на ультраструктурном (биохимическом) уровне.
Целью настоящей работы являлось изучение структурно-функционального состояния компонентов периферической крови у женщин (вне беременности) с типичной формой генитального герпеса при проведении эндоваскулярной лазерной терапии.
В исследуемую группу были включены 20 пациенток в возрасте от 20 до 45 лет с типичной формой генитального герпеса. Под наблюдением гинеколога они находились в течение 5 лет и более. Контрольную группу составили 10 здоровых женщин репродуктивного возраста. Диагноз генитального герпеса подтвержден наличием антигенов ВПГ, обнаруженных прямым методом флюоресцирующих антител в соскобах эпителия вульвы, влагалища, шейки матки. Результаты считались положительными при двукратном выявлении изумрудно-зеленого свечения ВПГ и специфических герпес-вирусных включений в цитоплазме эпителиальных клеток в исследуемом материале. Больные жаловались на эпизодически появляющиеся типичные герпетические мелкопузырьковые высыпания различного диаметра, расположенные группами или одиночно на малых половых губах, слизистой оболочке влагалища или шейке матки. Пациентки отмечали общее недомогание, головную боль, выраженное увеличение лимфатических узлов, пониженную работоспособность. Больных беспокоили изнурительный зуд и жжение в области наружных половых органов, не поддающиеся какому-либо лечению, что в значительной мере являлось препятствием для половой жизни, приводило к нервно-психическим нарушением, неврастеническим и депрессивным расстройствам.
Медикаментозное лечение этих больных давало временный эффект. Частота рецидивов заболевания колебалась от 3 до 12 раз в год и составила 4,8+/-1,2 раза в год, средняя продолжительность ремиссии была 2,4+/-0,8 мес. Все пациентки имели регулярный менструальный цикл. Половой жизнью вне брака жили 8 женщин, остальные 12 состояли в браке. Смена 2-3 половых партнеров и более имела место у всех пациенток. Удалось выяснить, что у 4 половых партнеров периодически на половых органах отмечались герпетические высыпания.
У 4 (20%) пациенток исследуемой группы было невынашивание беременности, 2 (10%) женщины страдали бесплодием. У всех больных с типичной формой генитального герпеса отмечался хронический сальпингоофорит.
Для эндоваскулярного лазерного облучения крови использовалось гелий-неоновое излучение с применением аппарата УЛФ-01. Мощность излучения на выходе составила 1 мВт, длина волны - 0,63 нм, время экспозиции - 15-30 мин. Процедуры проводились ежедневно в течение 7-10 дней. Одновременно осуществлялось лечение половых партнеров пациенток исследуемой группы лекарственными средствами и ЭЛОК. Забор крови у больных производился из локтевой вены до и после курса ЭЛОК. У женщин контрольной группы забор крови для исследования производился однократно на 5-б-й день менструального цикла.
Для исследования клеточных и макромолекулярных компонентов использовался электронно-микроскопический препарат концентрата клеток периферической крови. Изучали эритроциты, тромбоциты, гранулоциты, лимфоциты, моноциты и компоненты плазмы, находящиеся между клетками: ультрамикрофибриллы, ультрамикрогранулы, макромолекулярные комплексы, фрагменты клеток и атипичные компоненты. Исследуемую венозную кровь с гепарином отстаивали 15-20 мин, использовали верхний слой плазмы образовавшегося лейкоконцентрата. Собранную в конические пробирки плазму с клетками центрифугировали при скорости 1000 об/мин в течение 10 мин. Надосадочную жидкость удаляли, а к осадку приливали для префиксации клеток 1% раствор глутаральдегида на 0,1 М фосфатном буфере (рН 7,4) и центрифугировали в течение 10 мин, а затем 3 раза промывали в процессе центрифугирования в буферном растворе и дополнительно фиксировали 1% раствором четырехокиси осмия в 0,
1 М фосфатном буфере (рН 7,4) в течение 30 мин. После окончания процедуры фиксации электронно-микроскопический препарат концентрата клеток крови готовился по обычной методике [2,3].Ультратонкие срезы получали с помощью ультрамикротома LKB-V (Швеция), контрастировали уранил-ацетатом и цитратом свинца, анализировали и фотографировали на трансмиссионном электронном микроскопе JEM-100 СХ (Япония). Исследовали несколько ультратонких срезов каждого экспериментального варианта и параллельных препаратов, оценивали качественные и количественные ультраструктурные признаки клеток и клеточных популяций. Важно подчеркнуть, что приготовленные описанным способом электронно-микроскопические препараты структурных компонентов периферической крови позволяют изучать клетки в их естественной совокупности без предварительного повреждающего фракционирования, поскольку только электронная микроскопия дает возможность исследовать сколь угодно сложную структурную смесь. Кроме того, предварительная процедура обработки клеток крови, включающая осаждение и центрифугирование, как бы повторяет стадии ряда иммунологических тестов (например, реакции розеткообразования и т. п.), вследствие чего создаются условия для контактного взаимодействия клеток. Перечисленные условия способствуют выявлению наиболее полного разнообразия функциональных состояний клеток крови.
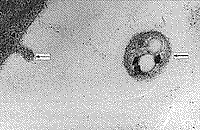
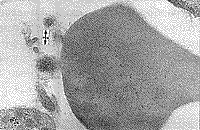
В результате электронно-микроскопического исследования структурных компонентов крови у больных до начала ЭЛОК выявлено наличие остатков микроорганизмов между клетками крови, которые были, очевидно, в состоянии деструкции в результате действия иммунных механизмов (рис. 1, 2). Однако микроорганизмы находили и внутри клеток (лимфоцитах), но в спорообразном состоянии (наличие толстой оболочки). Наблюдался также фагоцитоз нейтрофилами фрагментов клеток, содержащих микроорганизм (рис. 3,4).
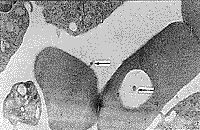
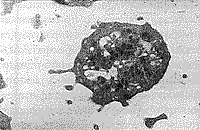
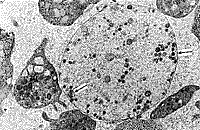
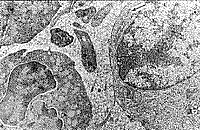
Наряду с обнаружением микроорганизмов в крови были выявлены и признаки цитопатического эффекта, которые можно предположительно связать с вирусной инфекцией. Так, отмечались повреждения поверхностной мембраны эритроцитов в виде почкообразных выпячиваний, часто отрывающихся от клетки в окружающую плазму (рис. 5, 6). Вирусоподобные частицы также наблюдались в углубленнях эритроцитов (рис. 7). Цитопатический эффект в более ярком виде выявлялся при исследовании тромбоцитов: на их поверхности имелись тонкие короткие и длинные отростки, а рядом множество вирусоподобных частиц (рис. 8). В межклеточной плазме также находили скопления вирусоподобных частиц, разделенных и контактирующих между собой (рис. 9, 10). Среди клеток имелись сильно поврежденные клетки (цитолитическое состояние) или их крупные фрагменты, в которых можно было видеть множество вирусоподобных частиц, часто прилегающих к внутренней поверхности мембраны клеток.
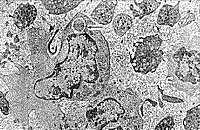
Подобная ультраструктурная картина периферической крови была выявлена и после курса ЭЛОК, но значительно чаще отмечалось присутствие бактерий и вирусоподобных частиц вне клеток, межклеточной плазме или во фрагментах разрушенных клеток. В межклеточной плазме обнаружены высокая контрацепция (плотность) неклеточных компонентов в виде макромолекулярных хлопьев и высокая активация тромбоцитов, нейтрофилов, лимфоцитов и моноцитов, которая выражалась в виде дегрануляции (высвобождении специфических гранул и лизосом), реакции фагоцитоза и синтеза иммуноглобулинов в развитой гранулярной эндоплазматической сети (активированные В-лимфоциты), а также в виде сильной контактной активности и особенно в местах нахождений бактерий и вирусоподобных частиц (рис. 11, 12).
| 
|
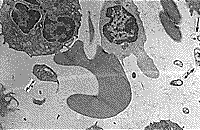
| Рис. 1. Контактное взаимодействие нейтрофила, шиповидного эритроцита и активированного лимфоцита. Рядом группа из 8 микроорганизмов. | Рис. 2. Группа из 4 микроорганизмов рядом с эритроцитом, около них макромолекулярные комплексы. |
| 
|
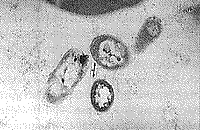
| Рис. 3. Лимфоцит, в цитоплазме которого находится микроорганизм в спорообразмом состоянии. Рядом активированные тромбоциты, между которыми высокая плотность макромолекулярных комплексов и наличие вирусоподобных частиц. | Рис. 4. Нейтрофил, содержащий фагоцитированный фрагмент, очевидно, лимфоцита с микроорганизмом в спорообразном состоянии. Рядом активированные тромбоциты и мелкие фрагменты клеток и вирусоподобные частицы. |
| 
|
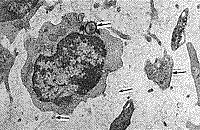
| Рис. 5. Вирусоподобная почка на поверхности эритроцита, рядом микроорганизм и макромолекулярные комплексы. | Рис. 6. Почкообразные образования на поверхности эритроцита, рядом вирусоподобные частицы. |
| 
|
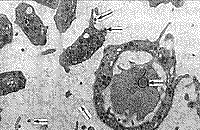
| Рис. 7. Плотные контакты между эритроцитами, почка на поверхности и вирусоподобная частица во впячивании эритроцита. | Рис. 8. Активированный тромбоцит и вирусоподобные частицы внутри, на поверхности и рядом. |
| 
|
| Рис. 9. Фрагмент клетки крови, содержащий вирусоподобные частицы, рядом в контакте активированные тромбоциты и макромолекулярные комплексы. | Рис. 10. Скопление контактных вирусоподобных частиц, высокая плотность макромолекулярных комплексов и активированные тромбоциты. |
| 
|
| Рис. 11. Активированный В-лимфоцит, в цитоплазме антителпродуцирующая мембранная сеть, рядом активированные тромбоциты и нейтрофилы, между клетками высокая плотность макромолекулярных комплексов. | Рис. 12. Активированный моноцит с фагосомой, в контакте другой активированный моноцит, рядом активированные тромбоциты, вирусоподобные частицы и высокая плотность макромолекулярных комплексов. |
Подобных изменений при электронно-микроскопическом исследовании периферической крови у здоровых женщин не наблюдалось.
Таким образом, многофакторный электронно-микроскопический анализ структурных компонентов периферической крови у женщин с генитальным герпесом позволил получить определенное представление о лечебном эффекте ЭЛОК. Известно, что при лазерном облучении клеток крови in vitro отмечена высокая фоточувствительность эритроцитов, содержащих естественный пигмент гемоглобин и обладающих большой светопоглощающей способностью. Вместе с тем некоторые авторы показали, что лазерное облучение клеток крови, не вызывая повреждения эритроцитов человека, обусловливает повышение их резистентности, активацию функции мембраны клеток с изменением электрических и сорбционных свойств ее поверхности [5]. Воздействие на лимфоциты красным светом гелий-неонового лазера с длиной волны 0,63 нм оказывает стимулирующее влияние на их функциональную активность, активирует иммунокомпетентные клетки крови [9]. При морфологическом исследовании периферической крови наблюдается повышение содержания нейтрофилов, эозинофилов, базофилов, моноцитов [11]. Это связано со стимуляцией лейкопоэза, с выбросом зрелых клеток из синусов костного мозга, сосудов селезенки и легких. Основной точкой приложения действия лазерного гелий-неонового излучения в лимфоцитах являются поверхностная мембрана клетки с ее рецепторами и ядрышко,
которые активизировались при лазерном воздействии. Есть также достаточные основания связать увеличение в крови числа нейтрофилов и моноцитов в состоянии сильно выраженной активации с высоким уровнем иммунных и антигенных комплексов, фрагментов клеточных рецепторов. В связи с этим, активацию нейтрофилов, моноцитов можно отнести к компенсаторным процессам, направленным на удаление из кровеносного русла в плазму разрушенных инфекционных агентов под воздействием гелий-неонового излучения. Никоэнергетическое лазерное облучение крови прежде всего вызывает разрушение поврежденных клеток с выходом бактерий и вирусов из клеток в межклеточную плазму, где они в свою очередь становятся доступными для иммунокомпетентных клеток и обезвреживаются в процессе фагоцитоза, действия специфических иммуноглобулинов с последующим контактным связыванием иммунных комплексов для нейтрализации инфекционных частиц. Такое представление подтверждается присутвием в периферической крови у пациенток высокоактивированных тромбоцитов, нейтрофилов, лимфоцитов и моноцитов на фоне высокой концентрации в плазме макромолекулярных компонентов. В плазме они подвергаются воздействию иммунокомпетентных клеток.Эти результаты согласуются с вирусологическими исследованиями, проведенными через 2-3 нед. после лазеротерапии. Выявлено незначительное увеличение экскреции вирусов. Кроме того, у 5 женщин в первую неделю после лазеротерапии отмечались легкие явления ОРЗ, что было расценено как активация элиминации вирусов слизистой оболочки верхних дыхательных путей. По результатам катамнеза и наблюдения пролеченных пациенток в течение 2-8 мес. выявлено увеличение продолжительности ремиссии на 5,4-1,1 мес. После повторного обследования в 72% случаев вирус простого герпеса не обнаружен.
Таким образом, реакция крови, развивающаяся при лазерном облучении, является одной из важных составляющих клинического эффекта биостимуляционной лазерной терапии. Выявленные в настоящей работе ультраструктурные особенности состояния эритроцитов, тромбоцитов, нейтрофилов, моноцитов и неклеточных макромолекулярных компонентов периферической крови у женщин с генитальным герпесом, как нам представляется, дают более полную информацию для понимания влияния лазерного излучения на вирусную инфекцию. ЭЛОК может явиться методом выбора лечения больных с данной патологией.
ЛИТЕРАТУРА
1. Баринский И.Ф., Шубладзе A.K., Каспаров А.Л., Гребенюк В.Н. Герпес. М., 1986. 205 с.
2. Бонарцев П.Д., Демидова Е.М.// Акуш. и гин. 1987. №10. С. 15-18.
3. Бонарцев П.Д., Демидова Е.М.// Вестн. АМН СССР. 1990. № 5. С. 23-25.
4. Иванов А.В., Купин В.И., Полевая Е.Б., Бучиладзе Л.И./Актуальные вопросы иммунотерапии опухолей. Рига, 1988. С. 119-120.
5. Инюшин В.М., Шабаев В.П.// Биологическое действие лазерного облучения. Межвуз. сборник, Куйбышев: Куйб. гос. ун-т, 1984. С. 23-29.
6. Калашкарян А.А., Делекторский В.В. и др.// Вести, дерматол. 1982. № 4. С. 4-7.
7. Козлов В.И., Буйлин В.А. Внутривенная лазеротерапия// Лазеротерапия. М., 1993. С. 72-79.
8. Константинова И.В., Калашкарян А.А. и др.// Иммунология. 1981. № 2. С. 36-39.
9. Косинская Н.П.// Тезисы докладов 4-го Всесоюзного съезда онкологов. Л., 1986. С. 527.
10. Кузник Б.И., Васильев Н.В., Цыбиков Н.Н. Иммуногенез, гемостаз и неспецифическая резистентность организма. М.: Медицина, 1989. 280 с.
11. Кузьмина В.Е., Варижников Ю.А.// Биологическое действие лазерного излучения. Межвуз. сборник. Куйбышев: Куйб. гос. ун-т. 1984. С. 51-60.
12. Мальцева И.Н., Эбралидзе Л.К., Звонарев А.Ю.// Сборник трудов НИИ эпидемиологии, микробиологии и инфекционных болезней. МЗ Каз. ССР. 1988. Т.36. С. 135-141.
13. Семенова Т.Е., Посевая Т.А. и др.// Вести, дерматол. 1987. № 6. С. 43-47.
14. Becker Т.М., Stone К.М., Cates W.// J. reprod. Меd 1986. Vol. 31. № 5. P. 358-363.
15. Boulanger G.C.D., Gandry G.// Gynecologie. 1986. Vol. 37. № 1. bis. P. 32-39.
16. Coleman R.M., Pereira L., Baileu P.D. et al.// J. Clin. Microbiol. 1983. Vol. 18. P. 287-291.
17. Kahlon J., Lakeman F.D., Ackerman M./ /J. Cln. Microbiol. 1986. № 6. P. 725-730.
18. Richard J., Deuman M.D.// J. reprod. Med. 1986. Vol. 31. №5. P. 454-464.
19. Sweet R.L., Gibbs R.S.// Infections diseases the female genital tract: Second edition. 1990. P. 145-169.
20. //Pediatrics. 1980. Vol. 66. P. 489-494.


Ваш комментарий