Муковисцидоз. Современные достижения и проблемы. Методические рекомендации
5. Диагностика
Необходимость ранней диагностики муковисцидоза определяется следующим:
- Раннее начало лечения МВ обеспечивает более высокий терапевтический эффект и улучшает прогноз заболевания.
- Своевременная постановка диагноза вносит ясность в понимание родителями состояния ребенка и позволяет им и больному вовремя адаптироваться к тяготам, связанным с хроническим заболеванием.
- Своевременная постановка диагноза позволяет семье вовремя решить необходимые вопросы, связанные с рождением здорового ребенка (генетическое консультирование, пренатальная диагностика МВ в последующие беременности).
- Отсроченность диагноза, а следовательно отсутствие адекватной терапии, может привести к развитию необратимых патологических изменений в легких.
- Без лечения нарушения со стороны желудочно-кишечного тракта могут привести к значительному отставанию в физическом развитии и недостаточности питания.
- Несвоевременность постановки диагноза МВ может быть сопряжена с излишними, сложными, дорогостоящими диагностическими и лечебными мероприятиями, связанными с лечением осложнений МВ.
Диагноз муковисцидоза, как правило, устанавливается на основании типичных клинических проявлений заболевания и подтверж дается высоким уровнем натрия и хлора в секрете потовых желез (потовая проба). Учитывая серьезность последствий, такой диагноз следует считать окончательным только на основании соответствующих достоверных доказательств. У большинства здоровых детей концентрации натрия и хлора в секрете потовых желез не превышают 40 ммоль/л, а в некоторых случаях не достигают и 20 ммоль /л. Если этот показатель принимает значения между 40 ммоль /л и 60 ммоль /л, потовую пробу следует повторить. При получении аналогичных по вторных результатов постановка окончательного диагноза требует тщательного анализа всех клинических признаков у данного пациента. Хотя у большинства детей, больных муковисцидозом, концентрация хлора оказывается выше 80 ммоль /л, диагностическими считаются значения, превышающие 60 ммоль /л. У больных зрелого возраста с относительно легкими клиническими проявлениями диагноз МВ устанавливается на основании повышенного содержания электролитов в секрете потовых желез, подтвержденного серией повторных потовых проб, с учетом основных признаков заболевания, таких как назальный полипоз, рецидивирующий панкреатит, азооспермия, снижение фертильности у женщин, дефицит электролитов и цирроз печени. В последнее время становится все более доступным генетический анализ, позволяющий во многом решить проблему диагностики муковисцидоза.
5.1. Потовая проба
Стандартная методика (метод по Гибсону-Куку) предусматривает использование количественного ионофореза пилокарпина: с помощью слабого электрического тока препарат вводится в кожу и стимулирует потовые железы. Собранный пот взвешивается, затем определяют концентрацию ионов натрия и хлора.
При соблюдении необходимых условий данный тест позволяет получить очень точные результаты. Ошибки в результатах обычно связаны с различными техническими погрешностями - неаккуратностью при сборе и транспортировке пота, очистке кожных покровов, взвешивании и определении концентрации электролитов. Ошибки в результатах чаще всего возникают в лабораториях, редко проводящих анализ потовых проб. Поэтому для подтверждения или исключения диагноза МВ следует направлять пациента в медицинские центры, в которых накоплен достаточно большой опыт проведения таких анализов. Для выполнения теста необходимо собрать минимум 100 мг пота.
Тест должен выполняться квалифицированным и опытным лаборантом. При положительном ответе потовую пробу следует повторить: для окончательного диагностического заключения требуется 2-3 положительные пробы и достоверные клинические доказательства.
Повторное проведение потовой пробы также рекомендуется, если: результаты первого теста сомнительные; результаты первого теста негативные, но клинические проявления позволяют с высокой вероятностью подозревать наличие МВ.
- Если результаты повторной потовой пробы сомнительны, но сохраняются веские клинические доказательства в пользу МВ или выявляются отдельные симптомы, характерные для МВ (например: стеаторея), рекомендуется проводить терапию, показанную больным с установленным диагнозом МВ. В этих случаях следует периодически повторять потовый тест. Уточнению диагноза может способствовать генетическое тестирование (при условии его доступности).
- Если не удается получить требуемое количество пота, рекомендуется стимулировать секрецию потовых желез с помощью теплового воздействия, кормления во время сбора пота или физических упражнений. Не следует также забывать о необходимости коррекции дегидратации, если таковая имела место незадолго до проведения потовой пробы. В области отека объем секрета потовых желез может быть сниженным. Повторная стимуляция в одной и той же области может привести к истощению потовых желез, что приводит к повышению концентрации электролитов.
- Концентрации натрия и хлора в поте обычно примерно одинаковые. Поэтому различия в уровнях натрия и хлора, превышающие 10 ммоль/л, должны настораживать клинициста в отношении возможности технических погрешностей при проведении пробы.
- У некоторых здоровых новорожденных в первые дни жизни могут отмечаться повышенные концентрации электролитов. Кроме того, сбор пота в этот период часто затруднен. Поэтому рекомендуется проводить потовую пробу не ранее первых 7 дней после рождения, некоторые специалисты предпочитают проводить тест детям старше месяца жизни, при возможности с проведением генетического обследования и определения хлоридов пота в динамике.
- Концентрации натрия и хлора в поте остаются неизменными на протяжении всего детского возраста. После достижения 15-летнего возраста, уровни натрия и хлора в секрете потовых желез здоровых лиц повышаются (иногда до 60-90 ммоль/л), но потовая проба в совокупности с клиническим симптомокомплексом сохраняет свое значение для диагностики МВ.
- Несмотря на свою специфичность, метод по Гибсону-Куку является длительным, трудоемким и зависит от опыта проводящего персонала. В связи с этим, постоянно ведутся разработки аппаратов, которые позволили бы унифицировать методику, сократить время проведения теста и уменьшить количество пота, необходимое для постановки диагноза. В середине 80-х годов в практику были внедрены аппараты "Макродакт" и "МВ-индикатор" американских фирм "Вескор" и "Скандифарм" для скрининг диагностики муковисцидоза. Данные аппараты предназначены преимущественно для исследований в условиях амбулаторной практики, небольших клиник или в отдаленных регионах; если их применение дает положительный результат, для окончательного подтверждения диагноза пациента необходимо направлять в авторитетный клинический центр. Преимущество данных аппаратов состоит в том, что для исследования требуется небольшое количество потовой жидкости (менее 100 мг); для проведения потовой пробы с помощью данных аппаратов не требуются лабораторные условия.
- При проведении потовой пробы могут встречаться пограничные, а также в небольшом проценте случаев как ложноположительные, так и ложноотрицательные значения хлоридов пота. В связи с этим, возникает необходимость в дополнительных, более чувствительных диагностических тестах. Одним из таких тестов является измерение трансэпителиальной разницы назальных электрических потенциалов.
Суть метода состоит в измерении разности потенциалов между электродами, один из которых располагается на поверхности слизистой оболочки носа, а второй на предплечье. В норме пределы разности потенциалов колеблются от -5 mV до -40 mV; у больных МВ эти пределы составляют от -40 mV до -90 mV. Изменение разности назальных потенциалов отражает основной дефект МВТР и является информативным методом диагностики МВ у детей старше 6-7 лет и взрослых. Однако, этот тест обычно доступен только в условиях специализированных клинических центров.
В табл. 5 перечислены состояния, в ряде случаев сопровождающиеся повышением содержания хлоридов пота. Следует помнить, что подобные ситуации встречаются крайне редко, а положительная потовая проба является высоко специфичным тестом для диагностики МВ.
Ложно негативные результаты: Наиболее частые причины: технические ошибки, тестирование новорожденных в первые дни жизни, детей с безбелковыми отеками (по ликвидации отеков потовая проба становится положительной), гипопротеинемией, а также при лечении антибиотиком Клоксациллин.
Таблица 5. Другие состояния, при которых потовая проба может быть положительной
- Синдром приобретенного иммунодефицита (СПИД)
- Недостаточность функции надпочечников
- Псевдогипоальдостеронизм
- Адреногенитальный синдром
- Синдром Дауна
- Синдром Кляйнфельтера
- Атопический дерматит
- Эктодермальная дисплазия
- Семейный холестатический синдром
- Фукозидоз
- Гликогеноз, тип II
- Недостаточность глюкозо-6-фосфатазы
- Гипотиреоз
- Гипопаратиреоз
- Семейный гипопаратиреоз
- Резко выраженная гипотрофия (кахексия)
- Нервная анорексия
- Синдром Мориака
- Мукополисахаридоз
- Нефрогенный несахарный диабет
- Хронический панкреатит
- Гипогаммаглобулинемия
- Целиакия
5.2. Генетическое тестирование
Генетическое тестирование на все возможные мутации, связанные с МВ, слишком дорого, так как число известных мутаций уже превышает 1000. Частота каждой из этих мутаций варьирует в широких пределах, подчас даже при сравнении соответствующих показателей между странами. Однако, если ни одна из 10 наиболее часто встречающихся в данном регионе мутаций не обнаруживается ни в одной из хромосом пациента вероятность диагноза МВ значительно снижается.
5.3. Неонатальная диагностика
Концентрации иммунореактивного трипсина (ИРТ) в крови новорожденных, страдающих МВ, почти в 5-10 раз превосходят уровни ИРТ у здоровых детей этого возраста.
Для измерения концентрации ИРТ высушенные пятна крови новорожденных исследуют с помощью радиоиммунного или ферменто-связанного анализа (ELISA или ФСА). Границы между ложно-позитивными и ложно-негативными результатами узкие - < 10%. Если планируемая программа неонатальной диагностики включает определение уровня ИРТ, следует учитывать соотношение стоимость/эффективность подобных мероприятий.
Неонатальная диагностика позволяет:
- Определить распространенность МВ в регионах, в которых диагностика МВ находится на недостаточно высоком уровне
- Своевременно выявить детей, страдающих МВ, и как можно раньше начать соответствующее лечение
- Выявить семьи, нуждающиеся в генетической консультации
5.4. Тесты на недостаточность функции поджелудочной железы
Для диагностики МВ обычно не требуется исследования всех функций поджелудочной железы: все зависит от выраженности клинических признаков, позволяющих подозревать МВ, и результатов потовой пробы. Однако перед назначением замещающей терапии панкреатическими ферментами необходимо провести копрологическое исследование и подтвердить наличие стеатореи.
При микроскопическом исследовании в кале больных МВ с недостаточностью функции поджелудочной железы выявляются маслянистые капельки нейтрального жира. Это простое, непрямое исследование функционального состояния поджелудочной железы в случае положительного результата значительно помогает в диагностике МВ.
Измерение концентрации фекального трипсина, обычно низкой или нулевой у больных МВ, также может подтвердить панкреатическую недостаточность.
Анализ на общее содержание жиров в стуле, выполняемый на материале, собранном в течение трех дней на фоне диеты с известным содержанием жира, не относится к числу необходимых для подтверждения диагноза недостаточности функции поджелудочной железы. Очень низкая или не определяемая концентрация иммунореактивного трипсина (ИРТ) указывает на экзокринную панкреатическую недостаточность, которая у большинства пациентов с МВ отмечается на первом году жизни.
Наиболее информативным и доступным на сегодняшний день следует считать тест на определение эластазы-1 в кале, который объективно отражает степень недостаточности экзокринной функции поджелудочной железы и не зависит от проводимой заместительной терапии панкреатическими ферментами.
Диагностическое значение непрямого метода определения панкреатической недостаточности "Эластаза - 1 в стуле" у больных муковисцидозом
Эластаза-1 (Э-1)- протеолитический фермент поджелудочной железы с молекулярным весом около 28 кДа. При физиологическом состоянии концентрация Э-1 в панкреатическом соке находится между 170 и 360 мкг/мл, что составляет около 6% от всех секретируемых панкреатических ферментов. При прохождении через желудочно-кишечный тракт панкреатическая Э-1 не изменяет своей структуры, поэтому её концентрация в каловых массах истинно отражает экзокринную функцию поджелудочной железы. На основе этого открытия в начале 90-х годов немецкой фирмой ScheBoТ·BioTech был разработан и доказал свою высокую специфичность иммуноферментный метод определения панкреатической Э-1 в стуле и в сыворотке крови для выявления хронического и острого панкреатита. Его показатели очень точно коррелируют с инвазивными тестами (секретин-панкреозиминовый и секретин-церулиновый). В России данная методика до последнего времени практически не применялась.
В нашей клинике изучалась специфичность и чувствительность метода определения Э-1 у 128 детей как для выявления панкреатической недостаточности у больных МВ, так и для дигностики МВ. Изучая чувствительность и специфичность метода для выявления панкреатической недостаточности мы сравнили показатели Э-1 больных МВ, с уже доказанной другими методами панкреатической недостаточностью и показателями контрольной группы. У всех детей, контрольной группы концентрация Э-1 оказалась в пределах нормы (более 500 мкг/г стула), что говорит о 100% специфичности теста. В то же время чувствительность выявления панкреатической недостаточности у больных МВ составила 93% (рис.2). Чувствительность метода для постановки диагноза МВ составила 86,6%. Наши результаты совпадают с результатами подобных исследований, проведенных за рубежом. Кроме того, нами была выявлена отрицательная корреляция между концентрацией Э-1 и дозой панкреатических ферментов (единиц липазы/кг массы/сутки), принимаемой больными. Таким образом, измерение концентрации Э-1 в стуле является простым, точным, непрямым и неинвазивным методом выявления панкреатической недостаточности у больных МВ. На уровень Э-1 не влияет проводимая терапия панкреатическими ферментами. Значение уровня Э-1 может помочь в подборе дозы заместительных панкреатических ферментов у больных МВ. Чем ниже показатели Э-1 в стуле, тем выше суточная доза панкреатических ферментов на кг массы. При нормальных значениях Э-1 (>200 мкг/г стула) следует пересмотреть необходимость в назначении панкреатических ферментов. Исследуя показатели Э-1 в динамике у больных МВ с сохранной функцией поджелудочной железы, можно выявить время, когда потребуется назначение панкреатических ферментов.
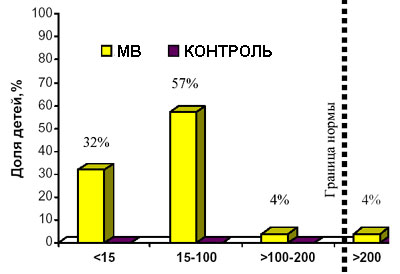
Рис. 2. Распределение больных МВ с пакреатической недостаточностью (n =108) и здоровых детей (n=16) в зависимости от концентрации эластазы 1 в стуле
5.5. Исследование функции внешнего дыхания
Исследование функции внешнего дыхания является важным элементом характеристики тяжести бронхолегочного поражения и оценки эффективности проводимой терапии. Диагностическая ценность исследования функции внешнего дыхания (ФВД) возрастает при обследовании детей старше 5-8 лет.
При МВ обструкция начинается с мелких бронхов, а затем распространяется на более крупные. Результаты простых тестов на степень обструкции зависят от сотрудничества пациента с врачом, проводящим исследование.
Пиковая скорость выдоха (ПСВ) - максимальная скорость потока воздуха во время форсированного выдоха после максимально глубокого вдоха. Этот показатель измеряется с помощью портативного Пикфлоуметра. Нормативные значения составляют > 80% от должных величин с учетом роста и пола.
Форсированная жизненная емкость легких (ФЖЕЛ) - суммарный объем воздуха при форсированном максимальном выдохе после максимально глубокого вдоха. Оценивается с помощью спирометра, который обычно значительно превосходит по размерам Пикфлуометр. Однако недавно появились и портативные модели аппарата.
По мере прогрессирования хронического бронхолегочного процесса отмечается снижение объема форсированного выдоха за 1 секунду (ОФВ 1 ), кривой жизненной емкости легких и ФЖЕЛ. Снижение указанных показателей на поздних стадиях заболевания связано с разрушением паренхимы легких и нарастанием рестриктивных расстройств.
У детей, больных МВ, возможно нарастание бронхиальной лабильности (гиперреактивности бронхов). С помощью методов оценки функции легких можно измерить уровень реакции бронхов на бронходилятаторы и выявить пациентов, у которых применение этих препаратов будет эффективным.
5.6. Пренатальная диагностика муковисцидоза
Вероятность рождения больного МВ в семье, где уже есть больные с этим заболеванием, составляет 25% при каждой беременности. В настоящее время в связи с возможностью ДНК-диагностики у конкретного больного МВ и его родителей реальна дородовая диагностика муковисцидоза у плода. Другими словами, "информативным" семьям, желающим иметь ребёнка, практически в 96-100% случаев гарантируется рождение ребенка без МВ. Для этого семье больного МВ (ребенку с МВ, а также обоим родителям) необходимо еще до планирования беременности провести ДНК-диагностику и проконсультироваться у врача-генетика для получения заключения об информативности пренатальной диагностики МВ в данной семье. При возникновении каждой новой беременности семье необходимо сразу же (не позднее 8 недели беременности) обратиться в центр дородовой диагностики, где на строго определённых сроках беременности врач-генетик проводит либо генетическую (8-12 неделя беременности), либо биохимическую (18-20 неделя беременности) диагностику муковисцидоза у плода.
В настоящее время многие семьи, имеющие больного муковисцидозом, уже имеют здоровых детей!
Центры дородовой диагностики муковисцидоза:
г. Москва, 115478 ул. Москворечье, 1, Медико-генетический научный центр РАМН (МГНЦ РАМН) лаборатория пренатальной диагностики тел. 324-21-46
зав. лабораторией проф. Золотухина Татьяна Владимировна
консультативная поликлиника
регистратура тел. 324-87-72
родильный дом №27 тел. 450-47-83 Юдина Елена Владимировна
ДНК- диагностика тел. 324-12-24 к.м.н. Петрова Ника Валентиновна
г. Санкт-Петербург, 199164 Васильевский Остров, Линия Менделеева, НИИ акушерства и гинекологии РАМН им. Д.О.Отта лаборатория пренатальной диагностики
зав. лабораторией проф. Баранов Владислав Сергеевич тел. 328-04-87
ДНК- диагностика тел. 328-98-09 д.м.н. Иващенко Татьяна Эдуардовна.
6. Организация службы диспансерного наблюдения и лечения больных МВ
В России диагностика и лечение больных МВ осуществляется на трех уровнях:
I - городской или районный (родильный дом, районная поликлиника или больница, городская больница)
II - областной или краевой (региональный центр муковисцидоза, областная или краевая больница)
III - Федеральный (Российский центр диагностики и лечения МВ, г.Москва, Российский центр дородовой диагностики, г. Санкт-Петербург).
Задачи I уровня:
- Заподозрить заболевание по клиническим признакам (мекониальный илеус, отставание в физическом развитии, характерная кишечная и респираторная симптоматика, наличие муковисцидоза у братьев и сестёр (сибсов) и др.).
- Если возможно, то провести биохимический потовый тест по Гибсону- Куку;
- Направить на консультацию в медицинское учреждение II уровня.
Задачи II уровня:
- Подтверждается (или исключается) диагноз МВ;
- Диспансерное наблюдение, используя рекомендации Российского центра МВ, проводится дополнительная клинико-функциональная диагностика и лечение.
Задачи III уровня:
- Детальное обследование больного МВ не реже одного раза в год, с выдачей заключения о дальнейшей тактике лечения.
- ДНК-диагностика, пренатальная диагностика МВ
- Плановое хирургическое лечение осложнений МВ.
После установления диагноза МВ желательно, что бы именно лечащий врач сообщил родителям о заболевании их ребенка. Родителям будет легче перенести такое сообщение, если они будут держаться в этот трудный момент вместе. Весьма вероятно, что во время первой беседы родители в связи с "шоковой" реакцией на сообщение о диагнозе и непривычностью медицинской терминологии не смогут усвоить всю необходимую для них информацию. Поэтому важно, чтобы объяснения врача были достаточно просты и понятны. Следует сразу назначить повторную встречу через 1-2 дня для повторного сообщения необходимой информации и ответов на вопросы, которые могут возникнуть у родителей больного. В этот период большую помощь могут оказать бабушки или дедушки пациента, так как родителям потребуется всесторонняя серьезная поддержка.
Другим представителям медицинского персонала (медицинским сестрам, психологам, социальным работникам, кинезитерапевту, диетологу), участвующим в лечении больного МВ, также следует уделить внимание родителям ребенка, объясняя или акцентируя их внимание на наиболее важных аспектах лечения.
Врачи из собственного опыта хорошо знают, что далеко не все родители пациентов способны адекватно оценить некоторые важные или ключевые факты, касающиеся МВ. Поэтому в качестве источника информации необходимо использовать соответствующую литературу, которая всегда должна быть доступна для родителей детей, больных МВ.
6.1. Активное диспансерное наблюдение больных МВ
Лечение больных МВ предпочтительно проводить в специализированных центрах. Терапия МВ не ограничивается рамками медикаментозного лечения: больным МВ требуется комплексная медицинская помощь при активном участии не только врачей, но и медицинских сестер, диетологов, кинезитерапевтов, психологов и социальных работников. Следует также активно вовлекать в процесс лечения обоих родителей пациента и обучать их необходимым навыкам помощи больному ребенку. В ряде случаев необходима генетическая консультация родителей и других близких родственников больного МВ.
Пациенты с МВ нуждаются в частых повторных обследованиях с целью своевременного выявления осложнений заболевания и своевременной терапевтической и/или хирургической их коррекции, позволяющей предотвратить необратимые последствия таких осложнений.
МВ относится к неизлечимым заболеваниям, поэтому пациенты нуждаются в активном диспансерном наблюдении и непрерывной терапии в течение всей жизни.
В условиях регионального центра МВ рекомендуется регулярное амбулаторное наблюдение за больными, с госпитализацией в специализированную клинику в случае развития инфекционных или других осложнений заболевания. В табл.6 приведен план регулярного ежеквартального и годового амбулаторных осмотров больных МВ в Российском Центре МВ. В рамках консультативного приема ребенок и родители получают необходимую информацию по дальнейшему лечению, питанию, консультируются кинезитерапевтом.
7. Терапия
Лечение МВ - трудная задача, требующая больших моральных и физических сил, прежде всего семьи и медицинского персонала, а также времени и значительных материальных затрат.
Цели терапии больного МВ:
- Поддержание образа жизни пациента, максимально приближенного к жизни здоровых детей
- Контроль над респираторными инфекциями
- Обеспечение адекватного питания
Обязательными составляющими лечения больных МВ являются:
- Лечебная физкультура (физиотерапия, кинезитерапия)
- Муколитическая терапия
- Антимикробная терапия
- Ферментотерапия препаратами поджелудочной железы
- Витаминотерапия
- Диетотерапия
- Лечение осложнений МВ
Таблица 6. План амбулаторного осмотра больного МВ в поликлинике регионального центра МВ
| ||||||||||||||||||||||||||||||||||
7.1. Терапия бронхолегочных проявлений
Патологические изменения в легких развиваются вторично, в результате формирования порочного круга: продукция вязкой слизи - обструкция - инфекция (рис.3).
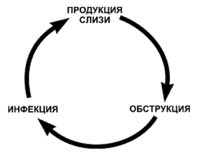
Рис. 3. Порочный круг, лежащий в основе бронхолегочного поражения при МВ
Терапия респираторной обструкции включает кинезитерапию, физические упражнения, применение бронхорасширяющих средств и муколитиков, включая ДНК-азу и амилорид.
7.1.1. Кинезитерапия
Учитывая обструкцию бронхов скоплением густой и вязкой мокроты, целесообразно наряду с муколитиками (препаратами разжижающими слизь) применение физических методов удаления мокроты.
Одним из наиболее важных и сложных компонентов терапии при МВ является лечебная физкультура (ЛФК) или кинезитерапия (в западной терминологии используется также термин физиотерапия), основной целью которой является очищение бронхиального дерева от вязкой мокроты, блокирующей бронхи и предрасполагающей к инфекционному поражению легких.
Разработано несколько методик кинезитерапии. В современной клинической практике используются следующие методики кинезитерапии: постуральный дренаж, перкуссия и вибрация грудной клетки (клопфмассаж), активный цикл дыхания и аутогенный дренаж. Также разработаны дыхательные упражнения с помощью флаттера и ПЕП-маски. Обучение различным методам кинезитерапии должно проводиться компетентным специалистом, владеющим этими методиками и способным оценить индивидуальный статус больного, функцию легких и уровень работоспособности, так как разного рода ошибки снижают ожидаемый эффект и могут оказать отрицательное влияние на состояние больного. Эффективность тех или иных методов варьирует в зависимости от индивидуальных особенностей больных МВ.
Чем меньше возраст ребенка, тем более пассивные методы кинезитерапии применяются. Новорожденным показана только перкуссия и компрессия (если их проведение возможно). По мере роста ребенка следует вводить более эффективные активные методики, с постепенным обучением пациентов и внедрением контролируемого откашливания. Активная позиция у ребенка старше 5 лет в отношении кинезитерапии вырабатывает у него ответственность за улучшение собственного состояния, делает его независимым. Регулярная кинезитерапия не только помогает лечить обострения хронического бронхолегочного процесса, но и предупреждать их. Она формирует правильное дыхание, тренирует дыхательную мускулатуру, улучшает вентиляцию легких и повышает эмоциональный статус ребенка.
7.1.2. Физические упражнения
С раннего детства необходимо поощрять желание пациентов заниматься любыми видами спорта (волейбол, езда на велосипеде, танцы, лыжи, плавание и т.д.). Нет смысла заставлять детей заниматься тем, что не приносит им удовольствия.
Ребенок должен выбрать тот вид спорта, который он считает интересным; чем больше он ему нравится, тем эффективнее результат. Физические упражнения облегчают очищение бронхов от вязкой мокроты и развивают дыхательную мускулатуру. Некоторые упражнения укрепляют грудную клетку и исправляют осанку. Регулярные физические нагрузки улучшают самочувствие больных детей и облегчают общение со сверстниками. Лишь в единичных случаях тяжесть состояния полностью исключает возможность физических упражнений. Однако, если состояние больного сравнительно тяжелое, следует начинать с минимальных нагрузок, а затем постепенно и осторожно их увеличивать.
Тем пациентам, которые испытывают смущение или недовольство при занятиях спортом в присутствии сверстников, можно рекомендовать домашние занятия с гимнастической скакалкой утром, сразу после пробуждения перед кинезитерапией или после возвращения из школы. Больным МВ может быть рекомендован широкий спектр видов спорта, однако в связи с повышенным риском травматизации некоторые из них широко не рекомендуются (табл.7).
Таблица 7. Виды спорта, рекомендуемые и запрещенные, для больных муковисцидозом
|
7.1.3. Муколитическая терапия
Применение муколитических препаратов направлено на разжижение бронхиального секрета и поддержание эффективного очищения бронхиального дерева от вязкой мокроты при МВ. В пульмонологической практике применяется несколько классов муколитических препаратов:
- Тиолы, способные своими сульфгидрильными группами разрывать прочные дисульфидные связи патологически вязкого геля мокроты: N-ацетилцистеин (используется ингаляционно, внутрь и внутривенно, выпускается в виде гранул, таблеток, порошков, растворов, применяется из расчета 30 мг/кг/сут. в 2-3 приема).
Флуимуцил - препарат группы ацетилцистеина, фирма ЗАМБОН, Италия применяется в виде растворимых порошков для приема внутрь, растворов для внутривенного введения и для ингаляций. Следует отметить, что Флуимуцил обладает не только активным муколитическим эффектом, но и имеет значительное антиоксидантное действие. Оригинальными, не имеющие аналогов в мире являются такие лекарственные формы той же фирмы, как Ринофлуимуцил - эффективный препарат в виде спрея для лечения синуситов, особенно эффективен при МВ и Антибиотик Флуимуцил - уникальное химическое соединение, представляющее собой ассоциацию N-ацетилцистеина и тиамфениколглицината, антибиотика группы хлорамфеникола. Такая комбинация способствует разрыву порочного круга между присутствием вязкого слизистого секрета и развитием бактериальной инфекции. Он показан для лечения бактериальных инфекций дыхательных путей, когда застой слизи осложняет состояние больного. Очень эффективно его применение при ингаляциях через маску для лечения хронических синуситов.
Эффективность перечисленных выше препаратов исследовалась как в ряде стран Запада, так и в бывшем СССР, а в последние годы в РФ. Полученные результаты свидетельствуют об их высокой активности. Отличительными свойствами всех форм флуимуцила является их хорошая переносимость и высокая эффективность. При применении флуимуцила у наблюдаемых нами больных было минимальное количество аллергических реакций и нарушений со стороны органов пищеварения.
- Стимуляторы выработки легочного сурфактанта: амброксолгидрохлорид (используется внутрь 1-2 мг/кг/сутки в 2-3 приема и внутривенно 3-5 мг/кг/сутки, выпускается в виде сиропа, таблеток, растворов для в/в введения)
- ДНК-аза гидролизует ДНК ядер распадающихся нейтрофиловсубстрата во многом определяющего патологическую вязкость мокроты (применяется ингаляционно в дозе 2,5 мг в сутки, выпускается в виде раствора для ингаляций 2,5 мг в 2,5мл, хранится в холодильнике при t ? - 0 +4 ?С)
Пульмозим - рекомбинантная человеческая ДНКаза обладает выраженным муколитическим протововоспалительным эффектом. ДНК-аза гидролизует ДНК ядер распадающихся нейтрофилов-субстрата во многом определяющего патологическую вязкость мокроты больных МВ. Пульмозим значительно снижает вязкость мокроты, ее способность к адгезии и улучшает мукоцилиарный транспорт. Наши клинико-функциональные наблюдения за более чем 60 больными, получающими Пульмозим, доказали его высокую эффективность. У детей, применяющих Пульмозим в течение года, достоверно (на 29%) снизилась частота респираторных эпизодов, уменьшилась тяжесть течения бронхолегочных обострений, частота и длительность госпитализаций и курсов антибактериальной терапии. Отмечено клинически значимое увеличение массо-ростового соотношения (МРС) на 10,8%, улучшение показателей ФЖЕЛ на 5% и ОФВ 1 на 6%. У тяжелых больных выявлена аналогичная тенденция в динамике ФВД при более низких темпах улучшения МРС. На фоне терапии Пульмозимом снизилась степень обсеменения мокроты St. aureus и P.aeruginosa. Отмечена положительная динамика в течение воспалительного процесса в легких по данным маркеров воспаления. У маленьких больных (в возрасте до 5 лет) Пульмозим эффективен при условии правильной техники ингаляционной терапии через маску.
Осложнения (ларингит, фарингит, астматический синдром) при применении Пульмозима встречаются нечасто, не имеют тяжелых последствий. Ларингит, фарингит, как правило, купируется в течение 1-2 недель без отмены препарата. При астматическом синдроме в ряде случаев возникает необходимость в отмене препарата. Пульмозим следует с осторожностью назначать детям с аллергическими заболеваниями, бронхиальной астмой.
Следует помнить, что больным МВ противопоказаны средства, подавляющие кашель, в частности препараты с добавлением кодеина.
Все способы разжижения мокроты необходимо сочетать с удалением ее из дыхательных путей, используя методы кинезитерапии.
7.1.4. Ингаляционная терапия
Ингаляционная терапия (аэрозольтерапия) - лечение вдыханием лекарственных веществ. Мелкая дисперсия лекарственного препарата обеспечивает его глубокое проникновение в дыхательные пути. Ингаляционное применение муколитиков позволяет оказать максимальное лечебное действие на слизистую оболочку дыхательных путей и улучшить реологические свойства вязкой мокроты. Аэрозоли антибиотиков применяются в дополнении к системно проводимой антибиотикотерапии при МВ для достижения более высокой концентрации препаратов в бронхиальном секрете.
В нашей клинике применяются следующие рекомендации по проведению ингаляционной терапии в комплексе с кинезитерапией:
- За 5 минут до ингаляции следует принять препарат, профилактирующий бронхоспазм (сальбутамол и др.).
- Перед ингаляцией необходимо очистить верхние дыхательные пути (тщательно высморкаться), при необходимости закапать в каждую ноздрю по 1 капле сосудосуживающего средства.
- При проведении ингаляции больному следует принять правильное положение: сесть прямо, расправить грудную клетку, плечи и лопатки опущены вниз.
- Ингаляция муколитика (N-ацетилцистеин, физиологический раствор и др.). Респираторная техника ингаляции: на счет "1-3" делается спокойный глубокий вдох через рот, после чего следует закрыть рот и задержать дыхание на 2-4 секунды. Затем, на счет "4-9" - спокойный выдох через нос (у маленьких детей - можно через рот).
- Длительность ингаляции одного препарата не должна превышать 8-10 мин.
- Кинезитерапия: дыхательная гимнастика, дренаж, ЛФК.
- Ингаляция антибиотика и через спейсер топического кортикостероида.
- При включении в схему ингаляционной терапии Пульмозима следует учитывать, что его применение рекомендовано через 30-40 мин после ингаляции любых других лекарственных препаратов. Предлагается несколько вариантов приема Пульмозима в зависимости от распорядка дня больного и объема применяемой им ингаляционной терапии.
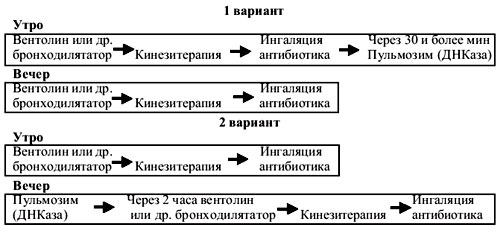
7.1.5. Антибиотикотерапия
С рождения больные с МВ предрасположены к развитию бактериальной инфекции дыхательных путей. В ее основе лежит биологический механизм, связанный с генетически обусловленным дефектом синтеза МВТР. Вирусная инфекция повышает риск и обычно ускоряет развитие бактериальной инфекции.
Спектр бактериальных патогенов при МВ остается на удивление ограничен. В классическом варианте в раннем возрасте развивается стафилококковая, а в последующем инфекция, обусловленная H. influenzae и P. aeruginosa. В последнее время возросла роль B. cepacia и обсуждается роль Stenotrophomonas maltophilia.
В настоящее время средняя продолжительность жизни больных МВ увеличилась по сравнению с прошлыми десятилетиями и составляет 32 года, но она значительно ниже, чем у людей без МВ. Основной причиной смерти являются дыхательные расстройства, вызванные хронической легочной инфекцией. У большинства больных эта инфекция впервые появляется в раннем возрасте. Продолжительность жизни очевидно больше у больных без хронической легочной инфекции. В США в случае отсутствия высева патогенных микроорганизмов из бронхиального секрета (в этом случае можно предположить отсутствие бактериальной инфекции) продолжительность жизни в среднем составляет 39 лет, у больных с хронической синегнойной инфекцией - 28, при высеве Burkholderia cepacia (B. Cepacia) - 6 лет. Прогрессирование бронхолегочного процесса нарастает после развития хронической синегнойной инфекции. Медленное (около 4% в год) снижение показателей функции внешнего дыхания характерно для больных МВ, однако у многих больных без хронической легочной инфекции показатели легочной функции остаются стабильными в течение многих лет.
Можно считать установленным, что применяемые в настоящее время различные режимы оральной, ингаляционной и внутривенной антибиотикотерапии (АТ) могут предупредить или задержать развитие хронической инфекции нижних дыхательных путей. При развившейся легочной инфекции применение адекватных режимов АТ позволяет замедлить темп прогрессирования легочных расстройств.
Показания для назначения антибиотиков при МВ
До настоящего времени нет единого мнения о том, как долго и как часто следует применять антибиотики у больных МВ. Однако в последние годы в тактике антибактериальной терапии МВ наметилась отчетливая тенденция к более раннему (при появлении первых признаков обострения бронхолегочного процесса) назначению антибиотиков и более длительному их применению, а также их применению с профилактической целью.
Основными клиническими симптомами обострения у больных МВ являются: изменение характера кашля, появление ночного кашля, увеличение количества мокроты и изменение ее характера, нарастание одышки, лихорадка, учащение пульса, ухудшение аппетита, падение веса, снижение толерантности к физической нагрузке, цианоз, ухудшение физикальной и рентгенологической картины в легких, показателей ФВД, признаки воспаления по данным лабораторных методов исследования. Важным является мнение врача, постоянно наблюдающего данного ребенка с МВ, о появлении у больного признаков обострения бронхолегочного процесса.
Выбор антибиотика определяется видом микроорганизмов, выделяемых из бронхиального секрета больного МВ, и их чувствительностью к антибиотикам. Забор бронхиального секрета для бактериологического исследования осуществляется при откашливании мокроты в стерильную посуду или при невозможности откашливания берется мазок из глубоких отделов задней стенки глотки. Микробиологический анализ мокроты у больных МВ следует проводить не реже, чем 1 раз в 3 месяца.
Особенности фармакокинетики антибиотиков при МВ (увеличение системного клиренса, ускорение метаболизма в печени и увеличение почечного клиренса, максимальная концентрация антибиотиков в сыворотке крови у больных МВ ниже, чем при введении той же дозы препарата больным с другой патологией), внутрибронхиальное расположение микроорганизмов, плохое проникновение в мокроту большинства антибиотиков, часто встречающаяся у больных МВ антибиотикоустойчивость микроорганизмов, обусловливает необходимость введения высоких разовых и суточных доз антибиотиков.
Антибактериальная терапия при высеве из бронхиального секрета Staphylococcus aureus
Staphylococcus aureus является ведущим микробным агентом, высеваемым из бронхиального секрета больных МВ первых лет жизни.
Имеются данные о том, что длительное профилактическое назначение оральных противостафилококковых антибиотиков (флуклоксациллина, диклоксациллина) детям с МВ позволяет приостановить развитие ранних проявлений поражения дыхательных путей. Это лежит в основе тактики постоянного профилактического применения противостафилококковых антибиотиков у детей первых лет жизни в ряде центров МВ Америки и Западной Европы. В других же центрах МВ с целью санации мокроты профилактически противостафилококковые антибиотики назначаются курсами по 2 и более недели только при высеве из бронхиального секрета Staphylococcus aureus.
При лечении обострения бронхолегочного процесса при МВ, вызванного Staphylococcus aureus, частота курсов антибиотикотерапии продолжительностью обычно до 2 недель у разных больных может варьировать от 1-2 в год до очень частых повторных курсов с короткими интервалами между ними.
Чаще применяются противостафилококковые оральные антибиотики (флуклоксациллин, оксациллин, цефалоспориновые антибиотики 1-2 поколения, макролиды, ко-тримоксазол, клиндамицин, фузидиевая кислот, рифампицин). При тяжелом обострении бронхолегочного процесса стафилококковой этиологии широко применяются флуклоксациллин, цефалоспориновые антибиотики 1-2 поколения парентерально (табл.8). Антибактериальная активность против стафилококка и палочки инфлюэнции, фармакокинетические особенности лежат в основе успешного лечения тяжелого обострения бронхолегочного процесса введением цефтриаксона (роцефина) внутримышечно или внутривенно в дозе 50-80 мг/кг 1-2 раза в сутки. При обострении бронхолегочного процесса вызванного метициллинорезистентным стафилококком применяется ванкомицин внутривенно капельно медленно.
Таблица 8. Антибиотики, применяемые у больных муковисцидозом при высеве из бронхиального секрета Staphylococcus aureus и Haemophilus influenzae
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Антибактериальная терапия при высеве из бронхиального секрета Haemophilus influenzae
Haemophilus influenzae (палочка инфлюэнции) может приводить к выраженным дыхательным расстройствам у больных МВ. Высев ее может быть затруднен, т.к. для ее роста необходимы специальные питательные среды. Наличие Haemophilus influenzae можно предположить при выявлении в мазках мокроты большого числа Грам "-" микроорганизмов при отсутствии их роста на обычных питательных средах. Бактериальная инфекция, обусловленная H. influenzae, часто развивается на фоне ОРВИ.
АТ препаратами, активными в отношении H. influenzae, рекомендуется проводить профилактически при ОРВИ, при высеве H. influenzae из мокроты у больных МВ без признаков обострения бронхолегочного процесса и при обострении бронхолегочного процесса, вызванного H. influenzae. Длительность курса АТ обычно составляет 14 дней.
Применяется, согласно антибиотикограмме, один из перечисленных ниже антибиотиков: амоксициллин, цефаклор, цефиксим, кларитромицин, азитромицин, ко-тримоксазол. Реже, при сохранении признаков обострения бронхолегочного процесса и повторном высеве H. influenzae, рекомендуется проведение курса АТ внутривенно (цефтриаксон и др. цефалоспориновые антибиотики 2-го поколения).
Антибактериальная терапия при высеве из бронхиального секрета Pseudomonas aeruginosa
В настоящее время не вызывает сомнения, что продолжительность жизни и ее качество у больных МВ значительно улучшились с появлением новых антибиотиков (аминогликозидов, пенициллинов, цефалоспоринов 3-4-го поколений, фторхинолонов, карбапенемов), активных против P. aeruginosa (табл.9).
Таблица 9. Антибиотики, применяемые у больных муковисцидозом при высеве из бронхиального секрета Pseudomonas aeruginosa
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Антибиотикотерапия МВ при высеве из бронхиального секрета P. aeruginosa проводится:
- при обострении бронхолегочного процесса
- профилактически у больных без признаков обострения бронхолегочного процесса
- при первых высевах из мокроты P. aeruginosa с целью предупреждения развития хронической синегнойной инфекции
- больным с хронической синегнойной инфекцией с целью предупреждения прогрессирования бронхолегочного процесса.
Большинство антибиотиков, применяемых для лечения синегнойной инфекции, вводятся парентерально, обычно внутривенно. При внутривенной АТ больных с хронической синегнойной инфекцией следует руководствоваться следующими правилами:
- Терапия обычно проводится 2 антимикробными препаратами в расчете на лучший клинический эффект в результате их синергидного действия и для уменьшения риска развития антибиотикорезистентности.
- Для меньшей травматизации ребенка при внутривенном введении антибиотиков рекомендуется пользоваться внутривенными периферическими или центральными катетерами.
- Аминогликозиды применяются в комбинации с цефалоспоринами 3-4 поколений. Например: амикацин+цефтазидим или тобрамицин+цефтазидим или цефзулодин.
- Другие комбинации выбираются на основании результатов антибиотикограммы и под контролем клинического ответа на лечение. Например: тобрамицин+пиперациллин или амикацин+тиенамицин,или цефтазидим+азтреонам.
- Комбинация 2-х В-лактамных антибиотиков (пиперациллин, цефтазидим, цефепим, азтреонам, имипенем, меропенем и др.) не рекомендуется.
- Применение высоких доз антибиотиков связано с трудностью достижения их терапевтических концентраций в мокроте, особенностями фармакокинетики антибиотиков при муковисцидозе, а также в связи со способностью мукоидных форм P. aeruginosa образовывать пленку алгината, защищающую их от действия антибиотиков.
- Аминогликозиды и пенициллины (или цефалоспорины) нельзя смешивать в одном флаконе или шприце во избежание их инактивации. Внутривенное введение этих препаратов (струйное или капельное) должно проводиться раздельно.
- Длительность лечения составляет 14 дней и более. Критерием прекращения антибиотикотерапии является возврат основных клинических симптомов обострения бронхолегочного процесса (веса больного, показателей функции внешнего дыхания, характера и количества отделяемой мокроты и т.д.) к исходному для данного больного уровню.
- При обострении бронхолегочного процесса внутривенное введение антибиотиков начинается в стационаре, после появления положительной клинической динамики лечение может быть продолжено в амбулаторных условиях.
- При использовании аминогликозидов (по возможности) рекомендуется проводить определение их уровня в крови через 48 часов после первого введения. При применении высоких доз аминогликозидов определение их концентрации в сыворотке крови необходимо повторять 1-2 раза в неделю.
- Для избежания кумулятивного эффекта рекомендуется контроль за нефротоксичным и ототоксичным действием аминогликозидов.
- Важно при проведении антимикробной терапии ориентироваться на лабораторные результаты определения чувствительности выделенного микроорганизма или ассоциации микроорганизмов к антибиотикам. Однако следует помнить, что лабораторный тест на чувствительность микроорганизма к антибиотикам не всегда полностью совпадает с клиническим ответом на проводимую терапию.
- АТ является жизненно необходимой частью лечения больных муковисцидозом, но возможности ее ограничены без проведения адекватной кинезитерапии. Эффективность АТ значительно увеличивается при сочетании ее с эффективной дыхательной гимнастикой, направленной на удаление гнойной мокроты из бронхов.
В ряде центров МВ, в том числе и нашем, достигли хороших результатов лечения хронической синегнойной инфекции больных муковисцидозом при проведении профилактических курсов внутривенной АТ препаратами, активными по отношению к синегнойной палочке. При этом удается увеличить продолжительность жизни больных, без значимого нарастания антибиотико-резистентности микрофлоры. Учитывая высокую стоимость лечения хронической синегнойной инфекции, возможно начинать проведение профилактических курсов АТ при появлении прогрессивного (каждые 3 месяца) падения показателей функции внешнего дыхания.
С 1996г в Российском Центре муковисцидоза (г. Москва) проводится внутривенная АТ детям в домашних условиях. Этот режим в последние годы широко применяется во всех специализированных центрах муковисцидоза Европы и Северной Америки. Преимуществами переноса лечения из больницы в дом пациента являются: отсутствие риска перекрестной и суперинфекции, снятие психоэмоциональных проблем, связанных с госпитализацией, экономическая целесообразность.
Возможность проведения внутривенной АТ на дому обсуждается родителями больного ребенка с лечащим врачом и медсестрой. Учитываются различные факторы: состояние ребенка, место жительства семьи, возможность поддержки специалистами Центра, возможности семьи в проведении курса на дому (обеспечение необходимым оснащением), уровень коммуникабельности и образованности родителей ребенка.
При проведении внутривенной АТ терапии на дому главным залогом успешности лечения становится правильный уход за катетером, который осуществляют родители ребенка, обученные в Центре муковисцидоза. Занятие по обучению технологии процедуры - разведению и введению антибиотиков, а также правилам ухода за катетером, проводится медсестрой с высшим образованием с каждой семьей индивидуально. Иногда требуется несколько занятий.
Тщательная подготовка приносит большую пользу. Главная цель обучения - уверенность в компетентности родителей перед началом курса. Во время обучения некоторые родители решают, что предлагаемая методика слишком сложна, тогда предпочтение отдается стационарному лечению. Если же обучение было успешным, начинается подготовка всего необходимого. Родители закупают или получают по рецептам необходимое оборудование, согласно методическим рекомендациям (памятке), которую они получают в Центре муковисцидоза. Родителям даются номера телефонов Центра и медсестры, по которым всегда можно получить ответы на возникающие вопросы. Родители получают объективную информацию о возможных местных осложнениях катетеризации и путях их решения. Перед курсом внутривенной терапии больной вместе с родителями приглашается в Центр, где наряду с осмотром проводится обязательное первичное обследование (антропометрия, определение функции внешнего дыхания, пульсоксиметрия, микробиологическое исследование мокроты, клинический анализ крови), ставится периферический венозный катетер. Первое введение препарата проводится под наблюдением специалиста Центра муковисцидоза. Патронаж медсестрой Центра проводится в среднем 3 раза за 2 недели стандартного курса лечения. Наблюдение фиксируется в специально разработанном листе патронажа. Во время лечения больные ведут процедурный лист, копия которого направляется в районную поликлинику по месту жительства. По окончании лечения проводятся повторный врачебный осмотр, необходимые обследования и удаляется катетер.
За период 1996 - 2001 г.г. специалистами Российского Центра муковисцидоза было проведено 189 курсов внутривенной АТ терапии на дому 44 больным.
У всех больных лечение было успешно закончено. Ни у одного больного не было необходимости в госпитализации с целью продолжения терапии. Нами отмечен один случай побочной реакции в виде аллергической сыпи на назначенный антибиотик. Родители, среди которых не было ни одного медицинского работника, правильно проводили манипуляции. Все больные и их родители приветствовали эту стационарозамещающую технологию и высказали заинтересованность в продолжение такой практики.
Для обеспечения частых курсов внутривенной терапии у больных муковисцидозом в России используются периферические венозные катетеры.
Материал, из которого изготовлен катетер, имеет существенное значение при внутривенной терапии. Отечественные (российские) катетеры делают только из полиэтилена. Это самый простой в обработке материал, но он обладает повышенной тромбогенностью, вызывает раздражение внутренней оболочки сосудов, из-за своей жесткости способен перфорировать сосудистую стенку.
При выборе оборудования для катетеризации вен предпочтение отдается полиуретановым катетерам, применение которых существенно снижает частоту тромбозов и перфорацию сосуда. В Российском центре муковисцидоза (г. Москва) в течение последних 1,5 лет для проведения внутривенных курсов антибактериальной, а также муколитической терапии (в стационаре, в амбулаторных условиях, а также на дому) у детей от 0 до 18 лет, страдающих муковисцидозом, используются периферические внутривенные катетеры на игле "Джелко", "Джелко-2" и "Оптива-2" производства фирмы "Джонсон и Джонсон медикал" размерами 22G и 24G.
Настоящие катетеры выполнены из высококачественных материалов и соответствуют всем требованиям, предъявляемым периферическим внутривенным катетерам.
Катетеры удобны и безопасны в применении для медицинского персонала, хорошо зарекомендовали себя при продолжительной внутривенной терапии и при качественном уходе за ними в процессе проведения терапии практически не вызывают осложнений.
Наиболее частой в нашей клинике при лечении хронической синегнойной инфекции является комбинация цефтазидима с аминогликозидом (тобрамицин, гентамицин, амикацин).
Фортум (Ceftazidime) фирма Glaxosmithkline (Великобритания) - цефалоспориновый антибиотик 3-го поколения для парентерального применения.
Широкого спектра действия, активный в отношении грамотрицательных бактерий, включая P. aeruginosa. Действует бактерицидно, нарушая синтез клеточной стенки микроорганизмов, устойчив к действию большинства лактамаз, является одним из основных антибиотиков, применяемых в лечении хронической синегнойной инфекции у детей с МВ. В нашей клинике проводилось исследование по изучению фармакокинетикии цефтазидима при различных способах его введения больным МВ. Изучалась сравнительная эффективность 3 способов применения цефтазидима у детей с МВ. 95 детям с обострением бронхолегочного процесса цефтазидим вводили в/в струйно из расчета 150 мг/кг массы тела в сутки, из них 63 цефтазидим вводили 2 раза в сутки (разовая доза 75 мг/кг массы тела) (1 группа) и 32 (2 группа) - 3 раза в сутки (разовая доза 50 мг/кг массы тела).
12 детей владеющие техникой дыхательной гимнастики, со средне-тяжелым течением МВ при нетяжелом обострении бронхолегочного процесса получали цефтазидим ингаляционно 1 раз в сутки (3 группа). Ингаляции цефтазидима в дозе 1,5г независимо от массы тела (в среднем 50 мг/кг) проводились с помощью компрессионных ингаляторов фирмы "Pari-Boy"(фирмы PARI, Германия), после сеанса кинезитерапии с использованием специальной респираторной техники. Определение концентрации цефтазидима в сыворотке крови и бронхиальном секрете проводили методом диффузии в агар с использованием стандартной методики. Фармакокинетические исследования проводились совместно с кафедрой клинической фармакологии РГМУ (заведующий кафедрой - проф. Ю.Б.Белоусов). Клиническая эффективность АТ оценивалась по исчезновению клинических симптомов обострения бронхолегочного процесса (уменьшению кашля, количества мокроты, одышки, лихорадки, тахикардии, улучшению аппетита, прибавке веса, увеличению толерантности к физической нагрузке, увеличению уровня Sat O2, показателей функции внешнего дыхания (ФВД), улучшению физикальной и рентгенологической картины в легких) у больных МВ (хороший клинический эффект) или их уменьшению (частичный клинический эффект) сразу после окончания курса лечения. При в/в струйном введении цефтазидима хороший и частичный клинический эффект отмечен у 92% детей 1 группы и 84% детей 2 группы. Стойкость клинического эффекта оценивалась через 28-35 дней после окончания курса лечения цефтазидимом у 48 детей. При этом клинический эффект был сохранен у 72 и 44%% детей 1 и 2 группы соответственно. При ингаляционном применении цефтазидима у всех детей получена положительная клиническая динамика.
Концентрация цефтазидима в сыворотке крови и бронхиальном секрете определялась у 36 детей (по 12 детей из каждой группы) до первого введения антибиотика, через 30 мин - 1-2-4-8 час после окончания 1-го введения препарата. У больных 2 группы концентрация цефтазидима в сыворотке крови и бронхиальном секрете определялась также через 12 часов после введения, а у больных 3 группы через 12-24 часа после первого введения цефтазидима. Концентрация цефтазидима в сыворотке крови и бронхиальном секрете определялась у всех больных на 5-е и 14-е сутки перед введением очередной дозы препарата. Основные фармакокинетические параметры при различных способах введения цефтазидима представлены в таблице.
Фармакокинетические параметры при различных способах введения цефтазидима
| |||||||||||||||||||
При анализе полученных данных выявлено, что при увеличении разовой дозы цефтазидима до 75 мг/кг (при 2-х кратном в течение суток введении препарата) увеличивалось время сохранения в сыворотке крови концентрации препарата, превышающей МПК90 для синегнойной палочки до 9,5 часов, по сравнению с 7,5 час при разовой дозе цефтазидима 50 мг/кг (при 3-х кратном в течение суток его ведении). При этом в мокроте достигалась более высокая концентрация цефтазидима, превышавшая МПК для синегнойной палочки в 2 раза. При 2-х кратном введении цефтазидима в суточной дозе 150 мг/кг длительность сохранения концентраций препарата в мокроте, превышающих МПК90 для синегнойной палочки, составляла 8 часов, по сравнению с 4 часами при 3-х кратном введении той же суточной дозы. При этом отмечалось и 2-х кратное увеличение площади под фармакокинетической кривой в сыворотке крови и мокроте при 2-х кратном, по сравнению с 3-х кратным введении той же суточной дозы препарата. При ингаляционном введении 1500 мг цефтазидима в мокроте больных МВ определялись концентрации препарата, превышающие МПК90 для синегнойной палочки в 100-150 раз, при этом концентрации препарата, превышающие МПК для синегнойной палочки сохранялись в мокроте до 24 часов, а площадь под фармакокинетической кривой в мокроте в 20 раз превышала соответствующий показатель при в/в введении цефтазидима.
Соотношение AUC / MIC Ps.aer. (AUIC) в 1-2-3 группах больных составило 8,7: 22; 420, Cmax / MICPs.aer. 1,6; 2,2; 140, AUCsputum / AUCserum % 14+-4; 18+-8; 703+-17 соответственно. На основании полученных результатов можно сделать заключение о преимуществе 2-х кратного по сравнению с 3-х кратным в/в введении той же суточной дозы цефтазидима. Фармакокинетические параметры свидетельствуют о высокой эффективности ингаляционного применения цефтазидима у больных МВ, позволяющего доставить антибиотик в локус инфекции и создать там концентрации, превышающие MICPs.aer., недостижимые при системном введении препарата. Однако необходимо учитывать, что эффективность ингаляционной терапии, доза вдыхаемого антибиотика у детей зависит от владения и соблюдения техники дыхания, степени выраженности дыхательной недостаточности у ребенка. Кроме того, не вполне ясно насколько равномерно распределяется цефтазидим при его ингаляционном введении по всему бронхиальному дереву. Можно предположить, что концентрации препарата в условиях выраженной бронхообструкции в плохо вентилируемых отделах легких не являются столь высокими.
Учитывая снижение чувствительности P. aeruginosa к цефтазидиму, особое значение приобретает внедрение в практику лечения больных МВ новых антибактериальных препаратов, цефалоспоринового ряда и других групп (карбапенемы, пенициллины, активные по отношению к P. aeruginosa).
Максипим (Cefipime), фирма Bristol-Myers squibb, США- полусинтетический цефалоспориновый антибиотик 1V поколения. Обладает широким спектром действия в отношении грамположительных и грамотрицательных бактерий, штаммов резистентных к амногликозидам или цефалоспориновым антибиотикам III поколения, таким как цефтазидим. Высокоустойчив к гидролизу большинства В-лактамаз, обладает малым сродством в отношении В-лактамаз, кодируемых хромосомными генами, и быстро проникает в грамотрицательные бактериальные клетки, оказывает бактерицидное действие на чувствительные к нему микроорганизмы. Его применяли у 23 (39 курсов) больных с хронической колонизацией синегнойной палочки в возрасте от 4 до 14 лет с тяжелым и среднетяжелым течением МВ во время обострений хронического бронхолегочного процесса. Препарат вводился внутривенно струйно или капельно в дозе 150 мг/кг/сутки в 2-3 введения, средняя продолжительность курса составила 17 дней (14-21). Максипим применялся как в монотерапии, так и в комбинации с аминогликозидами. У всех больных, в том числе и у 12 больных при повторных курсах получен отчетливый клинический эффект уже на 5-6 день от начала терапии в виде улучшения клинических параметров и показателей функции внешнего дыхания.
Меронем (Meropenem) фирмы Astrazeneca (Великобритания) относится к классу карбапенемов. Бактерицидное действие обусловлено воздействием препарата на синтез клеточной стенки бактерий. Хорошее проникновение через клеточную стенку бактерий, высокий уровень стабильности к большинству В-лактамаз, значительная аффиность к белкам, связывающим пенициллин (PBSs), объясняют мощное бактерицидное действие Меронема против широкого спектра аэробных и анаэробных бактерий. Бактерицидные концентрации Меронема обычно соответствуют минимальным ингибирующим (МИК).
Некоторые микроорганизмы (метициллинрезистентные стафилококки, Enterococcus faecium, Stenotrophomonas maltophilia) обладают природной устойчивостью к карбапенемам. В нашей клинике Меронем применялся в виде монотерапии у 9 тяжелых больных, в случаях неэффективности традиционных антибиотиков, но в крайне тяжелых случаях назначалась комбинация с аминогликозидами (2 больных). Меронем вводили в разовой дозе 20-40 мг/кг, в три введения внутривенно капельно. Было проведено 26 курсов у 22 больных в возрасте от 6 до 16 лет, средняя продолжительность курса составила 15 дней, при этом не было выявлено побочных эффектов или случаев непереносимости препарата. У всех детей было зафиксировано улучшение со стороны физикальной картины в легких, купирование симптомов интоксикации, достоверное повышение показателей функции внешнего дыхания (как объемных, так и скоростных) в среднем на 15+-6% от исходных цифр, что является объективным показателем эффективности лечения у тяжелых больных.
Колимицин (полимиксин Е) - разрушает архитектуру клеточной стенки бактерии путем тесного связывания липосахаридными остатками и замещения ионов магния, необходимых для стабильности наружной мембраны, проникает в клетку через цитоплазматическую мембрану и вызывает необратимую утечку содержимого клетки и ее гибель. Отличается от полимиксина -А и -Д аминокислотным состоянием и жирно-кислотным остатком на трипептидной боковой цепи, что уменьшает его токсичность. В условиях формирования резистентности P. aeruginosa ко многим антибактериальным препаратам практически универсальная чувствительность ее к колимицину делает применение колимицина привлекательной альтернативой для внутривенной антибактериальной терапии. Причем мукоидные штаммы сохраняют чувствительность к колимицину нередко больше, чем немукоидные. Мы применяли колимицин в сочетании с ципрофлоксацином и в виде монотерапии в дозе 50 мг/кг/сутки в три введения в/в капельно у 5 тяжелых больных с резистентной к другим группам антибиотиков (цефалоспоринам, аминогликозидам) синегнойной палочкой и получили отличный клинический эффект в виде быстрого купирования симптомов тяжелого обострения хронического бронхолегочного процесса при отсутствии побочных эффектов или с их минимальными проявлениями в виде неврологической симптоматики, которая купировалась самостоятельно после отмены препарата. Случаев формирования резистентности при повторных курсах нами не выявлено. Таким образом, колимицин в/в может применяться с успехом у тяжелых больных для лечения обострений бронхолегочного процесса при условии мониторирования функции почек и неврологического статуса. Колимицин в ингаляциях может быть эффективен для эрадикации P. aeruginosa при первых ее высевах и для улучшения течения респираторного процесса у больных с хронической колонизацией P. aeruginosa
Тиментин (Ticarcillin, Clavulanic acid) - комбинированный полусинтетический антибиотик, содержащий натриевую соль тикарциллина - карбоксипенициллина с широким спектром бактерицидной активности и калиевую соль клавулановой кислоты - ингибитора бета-лактамаз с прогрессивно усиливающимся и необратимым действием. Действия бета-лактамаз, продуцируемых многими Грам "+" и Грам "-" бактериями, может привести к разрушению некоторых антибактериальных препаратов еще до начала их воздействия на бактериальную клетку. Калиевая соль клавулановой кислоты блокирует действие бета-лактамаз, что делает бактерии чувствительными к тикарциллину в концентрациях, которые быстро достигаются в организме больного.
Тиментин - антибактериальный препарат широкого спектра действия, активный по отношению к P. aeruginosa, выпускается во флаконах по 3,2 грамма (в упаковке по 4 флакона). Фирма - производитель Glaxosmithkline (Великобритания).
В Российском центре муковисцидоза проводились клинические исследования по эффективности и безопасности применения Тиментина в АТ 8 детей с тяжелым течением МВ, обострением бронхолегочного процесса по смешанному типу, высевом полирезистентной к антибиотикам Грам "-" флоры, чувствительной к карбенициллину. Препарат применялся в дозе 300 мг/кг/сутки в 4 введения, в/в капельно в сочетании с аминогликозидом в течение 14 дней.
Эффективность АТ оценивалась по клиническим показателям (симптомы интоксикации, степень дыхательной и сердечной недостаточности, степень мукостаза и характер мокроты, аускультативной картины в легких), а также показателям пикфлоуметрии, сатурированному кислороду, рентгенологической динамики, ФВД. На фоне комбинированной антибактериальной терапии выявлена стабилизация течения бронхолегочного процесса, улучшение физикальной картины в легких, умеренное улучшение показателей ФВД, уменьшение симптомов интоксикации. Применение Тиментина оправдано при наличии чувствительности к нему микрофлоры мокроты в качестве препарата первого ряда, в комбинированной терапии синегнойной инфекции у детей со среднетяжелым и тяжелым течением муковисцидоза, в дозе 300-400 мг/кг/сутки.
В таблицах 10 и 11 приводятся схемы профилактической АТ при хронической синегнойной инфекции и первых высевах P. аeruginosa из мокроты.
Таблица 10. Схема АТ, применяемая при хронической синегнойной инфекции
- Основной режим: 2-х недельный курс внутривенной АТ каждые 3 месяца всем детям с МВ при наличии у них хронической колонизации синегнойной палочки
- Применяемые антибиотики (выбор антибиотика по данным антибиотикограммы высеваемой у больного микрофлоры):
Тобрамицин 10-12 мг/кг/24 час (до достижения в сыворотке крови концентрации 1-2 мкг/мл)
+Цефтазидим 150-200 мг/кг/24час в/в
или +Цефипим 150 мг/кг/24час в/в
или +Меропенем 60-120 мг/кг/24час в/в или +другой антибиотик, активный против синегнойной палочки - Колистин 2-4 млн. ЕД/24 час или другой антибиотик в ингаляциях постоянно всем детям с хронической колонизацией синегнойной палочки. При клинической нестабильности: увеличение продолжительности курсов в/в АТ до 3 нед. и/или сокращение интервалов между курсами, и/или прием ципрофлоксацина*/офлоксацина 20-40 мг/кг/сутки внутрь между курсами в/в АТ
* В Российском центре МВ чаще всего используется цифлоксинал (фирма ПРО.МЕД.ЦС, Прага)
Таблица 11. Схема АТ для профилактики развития хронической колонизации P. aeruginosa
|
При проведении профилактических курсов АТ при первых высевах синегнойной палочки из бронхиального секрета частота перехода непостоянного носительства P. aeruginosa в хроническую синегнойную инфекцию снижается с 58% до 14%, а санация мокроты от P. aeruginosa составляет 80%.
Антибактериальная терапия при высеве из бронхиального секрета Burkholderia cepacia Burkholderia cepacia (известная ранее под названием Pseudomonas cepacia) высевается на специальных средах, подавляющих рост P. aeruginosa.
Инфекция, обусловленная B. cepacia вызывает большую озабоченность из-за ее мультирезистентности к антибиотикам и трансмиссивности некоторых ее штаммов. Течение Burkholderia cepacia инфекции при МВ различно. Примерно у 1/3 инфицированных больных отмечаются частые обострения бронхолегочного процесса, развивается так называемый cepacia синдром, проявляющийся фульминантной пневмонией, септицемией часто с плохим прогнозом, у других она видимо не влияет на течение заболевания. У больных с высевом Burkholderia cepacia более часто наблюдается суперинфекция, вызванная P. aeruginosa, St. aureus, H. Influenzae.
При выборе антибиотика для лечения обострения бронхолегочного процесса необходимо ориентироваться на результаты микробиологического исследования и антибиотикограмму. При тяжелом обострении бронхолегочного процесса, вызванном Burkholderia cepacia,, рекомендуется комбинация из 2 или 3-х антибиотиков (например: фторхинолоны + цефалоспориновые антибиотики 3-4 поколения или карбопенемы или хлорамфеникол + цефтазидим). Цефтазидим, меропенем, имипенем, ципрофлоксацин применяются в дозах, рекомендованных для синегнойной инфекции.
В случае нетяжелого обострения рекомендуется оральный прием хлорамфеникола (25 мг/кг х 4 р в день), котримоксазола, доксициклина (100-200 мг) 1раз в день для детей старше 12 лет, ингаляции цефтазидима.
Эффективным препаратом может оказаться Флуимуцил антибиотик ит (фирмы Замбон Груп С.П.А., Италия), который включает в себя антибиотик тиамфеникол и муколитик флуимуцил.
Поскольку заранее выявить пациентов, у которых развивается быстрое и тяжелое течение инфекции, вызванной Burkholderia cepacia, невозможно, а также учитывая антибиотикорезистентность возбудителя и связанные с этим трудности АТ, следует изолировать больных высевающих Burkholderia cepacia, из мокроты от других больных МВ.
Иногда в качестве случайной находки высевается другая патогенная микрофлора - Klebsiella pneumonie, Escherichia coli, Serrata marcescens, Stenotrophomonas maltophilia и Proteus. Роль этих микроорганизмов окончательно не установлена. В случае обострения бронхолегочного процесса, вызванного указанными микроорганизмами, антибиотик подбирается на основании тестов на чувствительность или назначаются препараты, традиционно эффективные при данных формах инфекции.
Аэрозоли антибиотиков
Аэрозоли антибиотиков применяются в дополнение к системно проводимой АТ при МВ для достижения более высокой концентрации препаратов в бронхиальном секрете.
Учитывая то, что аминогликозиды плохо проникают в бронхиальный секрет, достигая там лишь 12% от сывороточной концентрации, ингаляции аминогликозидов могут применяться как альтернативный системному пути введения способ лечения. При этом аминогликозиды практически не всасываются и к минимуму сводится возможность их токсического действия. Частота применения и доза аминогликозидов частично зависит от переносимости ингаляций больным (высокие дозы аминогликозидов в ряде случаев могут вызывать явления фарингита). В нашем центре используются постоянные ингаляции гентамицином в дозе 80-160-320 мг/сутки, что ведет к уменьшению частоты госпитализаций и респираторных эпизодов у части больных даже при хронической колонизации P. aeruginosa. Особенный интерес связан с тем, что ряд аминогликозидов, в том числе и гентамицин, могут восстанавливать функцию дефектного МВТР-белка с мутациями 1 типа (блок синтеза белка), такие как G 542X, W1282X и другие.
Колистин (Полимиксин-Е) может применяться для постоянных ингаляций при хронической синегнойной инфекции. Резистентность к нему P. aeruginosa наблюдается крайне редко.
При ингаляции антибиотиков следует уделять большое внимание техническим условиям проведения процедуры. Размер ингалируемых частиц не должен превышать 5 мкн, при этом по экспериментальным данным только 6-10% применяемого антибиотика достигают дистальных отделов легких, в связи с чем, увеличение доз антибиотиков для ингаляций не только безопасно для больного, но и оправдано. Для ингаляции антибиотиков рекомендуется использовать компрессорные ингаляторы.
Таблица 12. Антибиотики, применяемые при синегнойной инфекции ингаляционно
|


Ваш комментарий