Терапия-Раздел 5. Характеристика основной группы препаратов, применяемых для лечения ХСН
Раздел 5. Характеристика основной группы препаратов, применяемых для лечения ХСН
Член-корр. РАН, проф. Ю.Н. Беленков, проф. В. Ю. Мареев
URL
5.2.4. Общая характеристика
мочегонных
Классификация основных лекарственных средств, позволяющих усилить
выведение воды из организма, т.е. тех, которые мы можем отнести
к диуретикам или мочегонным средствам, традиционно строится исходя
из локализации их действия в нефроне (рис. 31 на стр. 87). Как
видно, первой зоной воздействия могут быть почечный клубочек (на
рисунке цифра 1) и препараты, увеличивающие
фильтрацию, можно с известной долей условности отнести к мочегонным.
К ним относятся положительные инотропные средства (в частности,
сердечные гликозиды), ксантиновые производные (эуфиллин), допамин.
Препараты первого класса усиливают фильтрацию, однако за счет
согласованного возрастания облигатной реабсорбции этот эффект
в большой степени нейтрализуется. Поэтому прирост выделения мочи
не достигает более чем 10%. Основной смысл применения этого класса
лекарств - это усилить действие основных классов мочегонных.
Особенностью допамина в отличие от большинства положительных
инотропных средств является то, что он дополнительно влияет на
почечный (клубочковый) кровоток и проксимальную реабсорбцию через
стимуляцию допаминовых рецепторов. Этот эффект не параллелен положительному
инотропному действию и при ХСН может иметь самостоятельное значение.
К основным мочегонным относятся препараты, влияющие на проницаемость
канальцев для натрия и воды и способные блокировать процессы реабсорбции. Эти препараты за счет своего влияния
на реабсорбцию ионов натрия и хлора получили наименование салуретиков.
Большинство современных диуретиков (за исключением урегита)
являются дериватами сульфаниламидов, точнее сульфомоильной кислоты
(рис. 33). Из рисунка видно, что остаток сульфомоильной кислоты
(обведен прямоугольником) присутствует в молекулах ингибитора
карбоангидразы (ацетазоламида или диакарба), тиазидов (гидрохлоротиазида
или гипотиазида), петлевых диуретиков (фуросемида, буметанида
или буфенокса). Как видно, разные по силе, механизму действия
и локализации эффекта в нефроне диуретики не имеют принципиальных
различий в химической структуре. Справа на рисунке 33 показана
принципиально отличная форма этакриновой кислоты, являющейся активным
компонентом петлевого диуретика урегита.
Различие в действии диуретиков зависит прежде всего от локализации
их действия в нефроне и интимного механизма влияния на реабсорбцию.
5.2.4.1. Препараты, действующие в области проксимальных
канальцев
В области проксимальных канальцев (зона 2 на рис. 31
на стр. 87) реабсорбируется до 80% профильтровавшейся мочи, однако
в основном этот процесс носит название облигатной (обязательной)
реабсорбции. Этот участок нефрона проницаем и для воды, и для
натрия, поэтому после его прохождения моча остается изотоничной
по отношению к плазме. Этот процесс зависит от взаимоотношения
гидравлического и коллоидно-осмотического градиента между проксимальным
канальцем и окружающими его капиллярами. Этот процесс тесно связан
с уровнем фильтрации, т.е. чем выше скорость фильтрации, тем большим
становится градиент, перемещающий жидкость и растворенные электролиты
(в эквивалентном количестве) из проксимального канальца в сосудистое
русло.
В области проксимальных канальцев действуют осмотические диуретики
и ингибиторы карбоангидразы.
Осмотические диуретики (маннитол) редко используются
для лечения ХСН, а во многих руководствах даже отмечается, что
они противопоказаны при тяжелой декомпенсации. Хотя опытные врачи,
особенно в экстренных ситуациях, помнят об этом небезопасном,
но в некоторых случаях последнем из возможных способов лечения
критических больных с ХСН.
В действии осмотических диуретиков можно выделить три фазы:
1. При попадании в кровоток они увеличивают осмотическое давление,
по типу <губки> втягивают жидкость из тканей в сосуды. На
этом основано их применение у пациентов с отеком мозга, повышенным
внутричерепным давлением, глаукомой. Процесс перемещения жидкости
из тканей в русло может быть очень активным (лавинообразным) и
трудно поддающимся контролю. При ХСН в этой фазе осмотические
диуретики могут привести к отеку легких, что является главным
ограничением к их использованию у этого контингента больных. В
любой момент может появиться необходимость в экстренном применении
петлевых диуретиков внутривенно (мы в нашей практике используем
внутривенную инфузию лазикса непосредственно перед или во время
введения осмотических мочегонных). Более того, врач, применяющий
маннитол при ХСН, должен быть уверенным, что он сможет достичь
быстрого и эффективного диуреза и контролировать состояние гемодинамики
малого круга. Проблема в основном состоит в том, что при хорошей
реакции пациента на петлевые диуретики маннитол не используется.
Как раз показанием к его назначению служит рефрактерный отечный
синдром, осмотические диуретики у больного с ХСН - это обычно
крик отчаяния.
2. После увеличения объема циркулирующей крови наступает вторая
фаза действия, связанная с резким увеличением фильтрации в почечных
клубочках, причем осмотические диуретики свободно фильтруются,
попадая в первичную мочу.
3. При попадании в проксимальные канальцы маннитол поддерживает
высокое осмотическое давление первичной мочи. Это <связывает>
эквивалентное количество растворенных электролитов и блокирует
степень облигатной реабсорбции. В итоге достигается увеличение
(иногда весьма значительное) диуреза.
Там же, в зоне проксимальных канальцев, действуют и ингибиторы
карбоангидразы, получившие свое название благодаря уникальному
механизму действия. Из препаратов этой группы обычно используется
ацетазоламид (диакарб).
Фермент карбоангидраза играет ключевую роль в метаболизме угольной
кислоты в эпителии проксимальных канальцев и поддерживает равновесие
между содержанием угольной кислоты, с одной стороны, и ионами
водорода и бикарбоната - с другой. Ионы водорода движутся в просвет
клубочка, обмениваясь на ионы натрия, которые реабсорбируются
вместе с бикарбонатами. Блокада карбоангидразы останавливает этот
ионообмен, приводя к накоплению ионов водорода и постепенному
ацидозу. В итоге нарушается реабсорбция натрия и незначительно
повышается диурез.
При нормальном кислотно-щелочном состоянии (при отсутствии
алкалоза) активность этого процесса невелика, поэтому диуретическое
действие диакарба весьма слабое. Кроме того, быстрое истощение
бикарбонатных ионов и развитие ацидоза с переизбытком ионов водорода
сильно снижает эффективность ингибиторов карбоангидразы после
3 - 4 дней непрерывного лечения. Иная ситуация при метаболическом
алкалозе, когда имеется переизбыток бикарбонатных ионов. Диуретическое
действие ингибиторов карбоангидразы усиливается и сопровождается
активацией ионообмена натрия на водород, блокадой реабсорбции
натрия и диурезом. В подобных случаях ингибиторы карбоангидразы
становятся важным подспорьем в диуретической терапии декомпенсированных
больных, о чем, к сожалению, обычно забывают практикующие врачи.
Рис. 40. Химическая
структура сердечных гликозидов
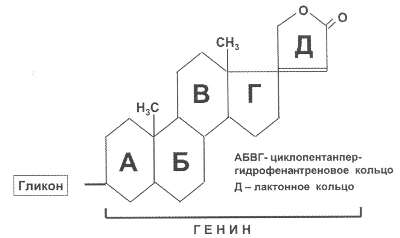
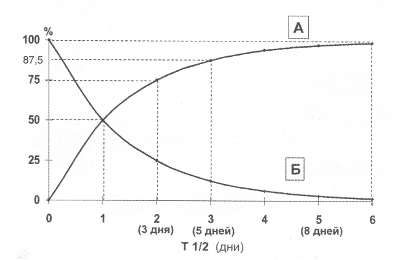
Рис. 41. Кривые нарастания (А) содержания гликозидов При насыщении и снижении (Б) их концентрации при отмене (% от максимума)
5.2.4.2. Диуретики, действующие
на восходящую часть петли Генле
В настоящее время в основном применяются два класса мочегонных
средств, действующих на восходящую часть петли Генле.
В этом разделе мы рассмотрим самые эффективные и популярные
диуретические средства, которые и олицетворяют собой в сознании
большинства практикующих врачей само понятие мочегонные.
Это связано с тем, что именно этот участок канальцев проницаем
для ионов натрия и именно
здесь возможно максимальное влияние на его реабсорбцию. Причем
на протяжении восходящей части петли Генле реабсорбируется до
30% натрия, из которых в кортикальном сегменте и дистальных канальцах
не более 5-7% (см. рис. 31 на стр. 87). Нисходящая часть петли Генле для ионов натрия непроницаема,
но по осмотическому градиенту благодаря ионам натрия, реабсорбирующимся
уже в мозговом слое восходящей части петли, диффундирует свободная
вода (пунктирная линия на рис. 31). Этот процесс носит название
<противоточный реабсорбционный градиент> (отмечено кругом
на рис. 31). Моча становится гипертоничной по отношению к плазме.
Однако после прохождения восходящей части петли Генле, получившей
также название <разводящий> сегмент нефрона, в которой интенсивно
реабсорбируются натрий и другие электролиты, моча становится гипотоничной
по отношению к плазме (сплошная линия на рис.31).
Тиазидные диуретики (гипотиазид, из более новых индапамид)
действуют на кортикальный сегмент петли Генле и в начальной области
дистальных канальцев, блокируя активность специального натриево-хлорного
транспортера. Их эффект на реабсорбцию натрия и, следовательно,
диурез умеренный (до +30% - +50% от исходного) и наблюдается лишь
при сохраненной функции почек (при клиренсе креатинина больше
30 мл/мин).
Наиболее мощными являются петлевые диуретики (фуросемид,
урегит, буметанид), которые блокируют активность специального
Na+/2Cl-/K+ транспортера в клетках канальцев на протяжении всего восходящего
сегмента петли Генле. Диуретическое действие этих препаратов наиболее
сильное (прирост диуреза при адекватной дозе превосходит 100%
от исходного) и сохраняется даже при сниженной функции почек (при
клиренсе креатинина не ниже 5 мл/мин).
Дополнительными свойствами петлевых диуретиков является способность
умеренно снижать активность карбоангидразы и стимулировать синтез
почечных вазодилатирующих простаноидов, прежде всего простагландина
E2 (ПГE2). Увеличение синтеза ПГE2 сопровождается дополнительным
усилением реабсорбции натрия в восходящей части петли Генле и
снижением реабсорбции свободной воды в собирательных трубочках.
Благодаря такому комплексу эффектов петлевые диуретики по праву
считаются незаменимыми в лечении выраженной ХСН.
Тем не менее между петлевыми и тиазидными диуретиками имеется
ряд серьезных различий, о которых необходимо помнить. Во-первых,
это несколько разная локализация действия в нефроне. Как видно
из рис. 31 на стр. 87, тиазидные диуретики влияют на реабсорбцию
в кортикальном сегменте восходящей части петли Генле, и эта зона
<перекрывается> петлевыми мочегонными. Но, кроме того, тиазидные
мочегонные влияют и на самую конечную часть петли Генле и начальную
часть проксимальных канальцев, на которые действие петлевых мочегонных
не распространяется. Во-вторых, точкой приложения действия в эпителиальных
клетках канальцев являются различные электролитные транспортеры.
Это говорит об особенностях каждого из рассматриваемых классов
мочегонных и противоречит распространенной в России точке зрения,
что тиазидные мочегонные вызывают большее число электролитных
расстройств и являются лишь ослабленной версией петлевых диуретиков.
Регулярное применение активных мочегонных чревато электролитными
расстройствами (потеря калия и магния) и развитием метаболического
алкалоза. Активация синтеза нейрогормонов (прежде всего РААС)
после обильного диуреза чревато новой задержкой жидкости в организме.
Как показано на рис. 16 на стр. 53, несмотря на разгрузку, достигаемую
при применении мочегонных, их нередко приходится применять повторно
(постоянно).
Кроме того, при постоянном применении эффект тиазидных и петлевых
препаратов ослабевает. Это может потребовать смены препаратов
этой группы или дополнительное назначение ингибиторов карбоангидразы,
устраняющих алкалоз.
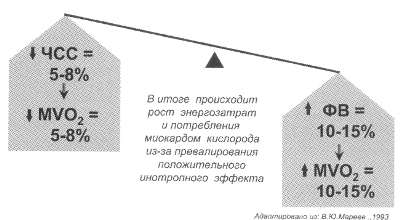
Рис. 42. Суммарный
итог действия сердечных гликозидов у больных с ХСН и мерцательной аритмией

Рис. 43. Суммарный итог действия сердечных гликозидов у больных с ХСН и синусовым ритмом
5.2.4.3. Диуретики, действующие
в области дистальных канальцев
В области дистальных канальцев происходит активный
ионообмен, в основном ионов натрия на калий, который регулируется
прежде всего влиянием альдостерона на специфические рецепторы,
расположенные в этой зоне. Поэтому диуретики, влияющие на дистальные
канальцы, вызывают довольно слабый диурез (+ 20% к исходному) за счет блокады
реабсорбции натрия. При этом замедляется выделение с мочой калия.
Поэтому препараты, влияющие на дистальные почечные канальцы, получили
название калий-сберегающих мочегонных.
К этой группе относится конкурентный антагонист АЛД альдактон,
о котором мы специально будем говорить в разделе 5.5. Кроме того,
в эту группу входят прямые блокаторы натриевых каналов в апикальных
клетках дистальных почечных канальцев триамтерен и амилорид. Эти
препараты редко применяются в России, хотя триамтерен входит в
состав популярного в недавнем прошлом диуретика триампур композитум.
Следует отметить, что при применении всех калийсберегающих
мочегонных рН плазмы крови возрастает, т.е. они вызывают развитие
ацидоза.
Далее представлены характеристика и основные фармакологические
свойства наиболее употребляемых диуретиков.
| ! | Гидрохлоротиазид (гипотиазид)
- препарат выбора для лечения умеренной ХСН. В дозах до
25 мг вызывает минимум побочных эффектов и электролитных
нарушений. В дозах выше 75 мг число побочных эффектов возрастает.
Максимальный эффект через 1 ч после приема, длительность
действия 12 ч. Усвояемость препарата (как и всех других
диуретиков) снижается после приема пищи, поэтому рекомендуемое
время приема утром натощак. Оптимальная комбинация с ИАПФ,
позволяющая усилить диуретическое действие при снижении
числа побочных эффектов. Фуросемид (лазикс) - наиболее известный из мощных петлевых диуретиков, с началом эффекта через 15-30 мин после приема, максимум через 1-2 ч и длительностью выраженного диуретического эффекта 6 ч. Выводится из организма почками, в соотношении: 60% - препарат и 40% - метаболиты. Применяется однократно (утром натощак). В случаях выраженной ХСН дозы варьируют от 20 до 500 мг и выше при рефрактерных отеках. Урегит (этакриновая кислота) - также петлевой диуретик, применяемый с той же целью и по тем же показаниям, как и фуросемид. Обладает похожими фармакодинамическими свойствами, но влияет на другие ферментные системы в восходящей части петли Генле. Выводится почками в соотношении: 65% - препарат и 35% - метаболиты. Поэтому при упорных отеках замена фуросемида на урегит или их совместное применение могут дать дополнительный эффект. Обычные дозы 50-100 мг, которые при необходимости могут повышаться до 200 мг. Буметанид (буфенокс) - сильный диуретик, нарушающий реабсорбцию натрия и хлора в толстом сегменте восходящей части петли Генле. Обычно используется в дозах 0,5 - 2 мг (максимальная доза 10 мг/сут). Назначается, как и все другие мочегонные, утром натощак. Начало диуреза через 15-30 мин, максимум через 1-2 ч, длительность до 6 ч. Выводится почками в соотношении: 60% - препарат и 40% - метаболиты. Может быть заменен на фуросемид или урегит и применяться в комбинации с ними у больных с упорным отечным синдромом при ХСН III - IV ФК. Ацетазоламид (диакарб) - слабый диуретик из группы ингибиторов карбоангидразы, действующий в области проксимальных канальцев. Единственный из диуретиков, повышающий рН и подкисляющий среду. Применяется в качестве дополнительного средства при длительном назначении мощных диуретиков для восстановления pH и чувствительности к петлевым мочегонным. Доза препарата 250 мг 2-3 раза в сутки в течение 3-4 дней с последующей отменой (перерывом) в лечении. |
Неконкурентный антагонист альдостерона
триамтерен применяется в суточной дозе 50 - 150 мг, при
этом он метаболизирует и диуретическим эффектом обладает в большей
степени его стабильный метаболит каннеренон. Начало действия через
2 ч после приема, длительность - 12 ч. Диурез, натриемия возрастают
в пределах 20% при одновременном уменьшении выделения калия (до
30%). Оптимальным является сочетание триамтерена с тиазидными
диуретиками в соотношении 2 : 1. На этой основе был сделан препарат
триампур, содержащий в одной таблетке 12, 5 мг гипотиазида
и 25 мг триамтерена. Минимальная доза при ХСН 2 таблетки, оптимальная
- 4, максимальная - 8 таблеток в сутки.
Отдельно необходимо отметить еще два препарата, которые, к
сожалению, мало известны в России, но очень широко применяются
в мировой практике лечения ХСН.
Торасемид (демадекс) - самый эффективный из современных
петлевых диуретиков. Биоусвояемость торасемида в 2 раза выше,
чем эталонного фуросемида (достигает 80 - 90% даже при ХСН). Препарат
на 80% метаболизирует в печени, поэтому почечная недостаточность
почти не влияет на его фармакодинамические свойства. В сравнительных
исследованиях с фуросемидом на 234 больных торасемид на 52% снижал
риск госпитализаций, связанных с обострением ХСН. Более того,
в проспективном исследовании 2303 больных с ХСН, рандомизированно
в соотношении 1:1 получавших торасемид или фуросемид, было продемонстрировано
достоверное снижение сердечно-сосудистой (на 53%, р< 0,013)
и общей (на 41%, р=0,035) смертности (D. Brater, 2000).
Метолазон (зароксолин)
- производное квиназолина по химической структуре и механизму
действия принадлежит к группе тиазидных диуретиков. Метолазон
- жирорастворимый препарат, легко проникающий в эпителиальные
клетки кортикального сегмента восходящей части петли Генле, несмотря
на выраженные явления почечной и сердечной недостаточности. Это
положительно отличает его от остальных тиазидных диуретиков. Другим
преимуществом метолазона является его длительный (до 24 ч) эффект.
Все это сделало сочетание метолазона с петлевыми диуретиками одной
из наиболее эффективных комбинаций в лечении ХСН.
5.2.5. Выбор диуретиков при ХСН
При начальных стадиях сердечной недостаточности (I
ФК, 1-я стадия ХСН по Российской классификации) диуретики применять
не следует.
При умеренной ХСН (II, иногда даже III ФК, IIA стадия по классификации
В.Х. Василенко и Н.Д.Стражеско) и сохраненной функции почек средством
выбора могут быть тиазидные диуретики. Удивительно, но в России
гипотиазид - крайне редкий гость в рекомендациях врачей-терапевтов
для пациентов с ХСН. Наиболее популярным способом терапии считается
использование петлевых диуретиков, даже тогда, когда клиническая
ситуация этого не требует.
С нарастанием тяжести декомпенсации приходится переходить к
применению более сильных петлевых диуретиков или комбинации двух
и более препаратов. Всегда полезна комбинация тиазидных или
петлевых диуретиков с ингибиторами карбоангидразы. После 2
нед лечения активными мочегонными развивается метаболический алкалоз.
В этих условиях эффективность тиазидов и петлевых мочегонных падает,
а диуретические свойства ингибиторов карбоангидразы увеличиваются.
Поэтому назначение диакарба в дозе 0,25г 3 раза в день на 3-4
сут может быть вдвойне полезным:
- за счет непосредственного диуретического эффекта;
- за счет изменения рН мочи в кислую сторону и восстановления
хорошего эффекта активных мочегонных препаратов.
Очень выгодной может быть и комбинация активных диуретиков
с калийсберегающими препаратами, действующими на дистальные
канальцы. Альдактон или триамтерен предотвращают развитие электролитных
расстройств и, так же как ингибиторы карбоангидразы, подкисляют
среду, что усиливает эффект активных диуретиков.
В самых тяжелых стадиях целесообразно сочетание петлевого диуретика
с тиазидным (лучше всего с метолазоном) или двух петлевых мочегонных
плюс антагонист АЛД плюс 1 раз в 2 нед по 3 дня ингибитор карбоангидразы.
Рис. 44. Кривые насыщения
дигоксином больных с ХСН
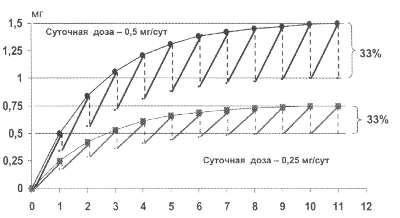
Рис. 45. Зависимость показателей смертности от дозы дигоксина у больных с ХСН и синусовым ритмом (исследование DIG)
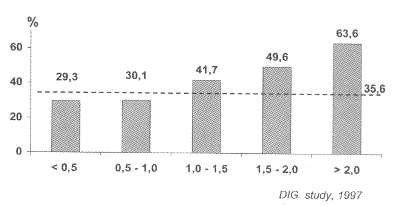
Рис. 46. Клинические, инотропные и нейрогормональные эффекты различных доз дигоксина при ХСН
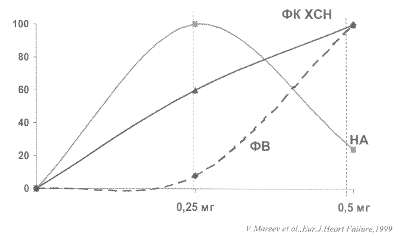
Рис. 47. Механизм развития кардиомиопатии перегрузки при ХСН
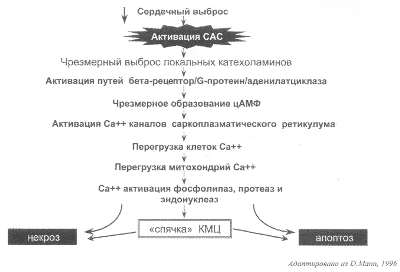
Рис. 48. Ремоделирование кардиомиоцитов (1)
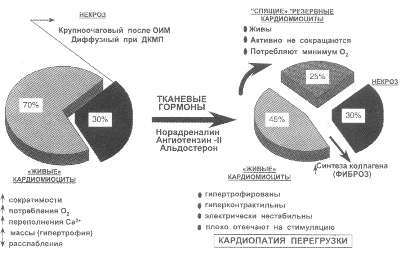
Рис. 49. Ремоделирование кардиомиоцитов (2)
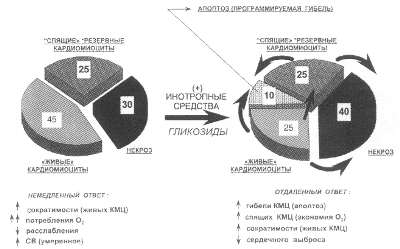
Рис. 50. Ремоделирование кардиомиоцитов (3)
5.2.6. Тактика лечения
диуретиками
Лечение мочегонными препаратами больных с ХСН проходит
две фазы - активную и поддерживающую.
Задачей активной фазы лечения является устранение избыточно
накопленной в организме жидкости, проявляющейся в виде отеков.
В этой фазе необходимо создать форсированный диурез с превышением
выделяемой мочи над потребляемой жидкостью на 0,8 - 1 л в сутки.
Параллельно масса тела должна ежедневно снижаться на 0,75 - 1
кг за сутки.
Принцип дозирования диуретиков - quantum satis, или доза увеличивается
до достижения требующегося эффекта. Терапия начинается с малых
доз диуретиков (до 50 мг гипотиазида или 20 - 40 мг фуросемида,
до 50 мг урегита или 1 мг буфенокса), которые потом при необходимости
могут быть увеличены. Необходимо помнить, что мочегонные препараты
всегда целесообразно назначать на фоне ИАПФ. Такая комбинация
(примером является препарат капозид) очень эффективна, причем
оба компонента потенцируют и усиливают действие друг друга, и
безопасна, так как позволяет избежать многих побочных реакций,
свойственных диуретической терапии.
Исследования показали, что применение капозида (25 мг каптоприла
и 12,5 мг в одной таблетке) эффективно и, самое главное, безопасно
даже при лечении наиболее неблагоприятной группы пожилых больных,
в том числе и с клинически выраженной ХСН. Применение этого препарата
при начальных стадиях декомпенсации может стать разумной альтернативой
подбору других диуретиков.
Важную роль играют анамнестические сведения, позволяющие оценить
успешность диуретической терапии в прошлом. Однако необходимо
помнить, что анамнестические указания на применение петлевых диуретиков
(например, у больных с умеренной декомпенсацией) не противоречат
тому, что считающиеся более слабыми тиазидные препараты могут
оказаться достаточно эффективными средствами дегидратационной
терапии. С другой стороны, у больного с IV ФК ХСН, сообщающего
о том, что он ежедневно принимает по 80 мг фуросемида без достаточного
эффекта, пробовать применить 50 мг гипотиазида бессмысленно.
После достижения оптимальной дегидратации больного переходят
к поддерживающей стадии лечения. В этот период количество выпитой
жидкости не должно превышать объем выделяемой мочи (оптимально
пациент должен выделять на 200 мл больше) и масса тела оставаться
стабильной. Главным в этой фазе лечения является ежедневное
применение подобранных мочегонных препаратов, позволяющих поддерживать
стабильный диурез и массу тела больного. Практика назначения "ударных"
доз мочегонных 1 раз в несколько дней порочна и тяжело переносится
больными. Лучше рекомендовать больному 12,5 - 25 мг гипотиазида
в сутки, чем 40 - 80 мг лазикса 1 раз в 5 дней. В последнем случае
пациент живет в порочном цикле. День приема диуретика он проводит
около туалета из-за чрезмерно обильного диуреза. На 2-й день он
полностью разбит, его мучит жажда, он страдает от электролитных
потерь (вплоть до появления судорог). На 3-й день пациент начинает
восстанавливаться. На 4-й он мог бы чувствовать себя бодрым, но
за прошедшие 3 дня накопившаяся жидкость вновь вызывает гипергидратацию
и одышку, что потребует на утро 5-го дня повторения ударного диуреза.
О каком высоком качестве жизни можно говорить при таком режиме
диуретической терапии?
Рис. 51. Взаимодействие
САС и РААС при ХСН
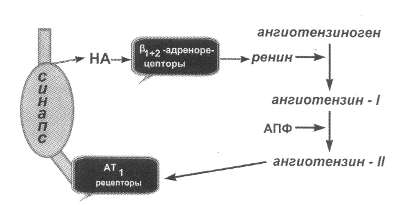
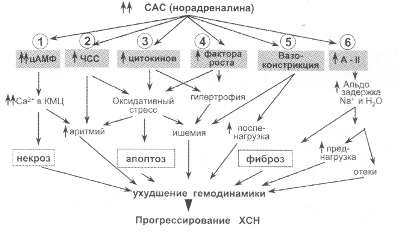
Рис. 52. Механизмы негативного влияния хронической гиперактивации САС на факторы, определяющие неблагоприятное течение ХСН
5.2.7. Особенности применения
диуретиков при рефрактерном отечном синдроме
5.2.7.1. Характеристика рефрактерности к мочегонным
Поскольку, как уже говорилось выше, практически все
современные диуретические препараты являются производными сульфомоильной
кислоты, то имеются общие принципы развития рефрактерности (устойчивости)
к терапии диуретиками и общие принципы выхода из создавшейся ситуации.
Принципиально, для того, чтобы диуретик оказал свое действие,
он должен:
1. Попасть в организм.
2. Абсорбироваться и попасть в кровоток.
3. Профильтроваться и попасть
в почечные канальцы.
4. Активно влиять на специфические транспортеры (переносчики
электролитов в апикальной мембране клеток почечных канальцев).
При появлении устойчивости к мочегонному препарату нарушается
один или несколько указанных звеньев общего процесса. Например,
при нарушении всасывания препарата мы можем сколько угодно повышать
дозу мочегонного средства, назначаемого перорально, и не достигнуть
успеха, и лишь перевод пациента на парентеральное диуретическое
лечение обеспечит достижение адекватного диуретического ответа.
Причинами, которые приводят к рефрактерному отечному синдрому,
являются:
1. Прогрессирование ХСН.
2. Появление и прогрессирование почечной недостаточности.
3. Гипотония.
4. Гиперактивация нейрогормональных систем.
5. Наличие дисбаланса электролитов и нарушения кислотно-щелочного
состояния.
6. Дис- и гипопротеинемия.
7. Развитие толерантности к действию диуретика.
Эти процессы и модулируют нарушения на всех этапах от попадания
диуретика в организм до достижения оптимального диуреза:
- из-за отека слизистой желудка и кишечника диуретик плохо
всасывается,
- из-за дис- и гипопротеинемии он недостаточно связывается
с белками,
- из-за гипотонии и нарушения функции клубочков он плохо фильтруется,
- из-за длительного повторного применения самого диуретика
развиваются электролитные, гормональные и кислотно-щелочные нарушения,
при которых действие мочегонного препарата ослабевает.
Последний момент, связанный с опасностью развития рефрактерности
к лечению мочегонными из-за их активного применения, почти не
освещен в отечественной литературе. В то время как убедительно
доказано, что имеются <ранняя> и <поздняя> рефрактерности
к лечению мочегонными, связанные с изменениями в нефроне в ответ
на активный диурез.
<Ранняя> рефрактерность получила название <торможение>
и развивается буквально через несколько дней активной диуретической
терапии. Причиной является резкая активация нейрогормонов (А II,
АЛД, катехоламинов, вазопрессина) и реакция на резко развивающуюся
гиповолемию (рис. 60 на стр. 176). В этом случае происходит <рикошетная>
задержка натрия, направленная на восстановление водного гомеостаза
организма (Dormans и соавт.,1998; Brater, 1999). Опасность <ранней>
рефрактерности тем выше, чем ретивее врач начинает дегидратировать
своего пациента. Диурез с превышением количества мочи над выпитой
жидкостью 2,5 л и более в сутки гарантирует получение <рикошетной>
устойчивости к лечению. Для преодоления ранней рефрактерности
необходимо сочетать мочегонные с ИАПФ. Причем в ответ на частое
сетование врачей, что ИАПФ не всегда можно назначить тяжелому
больному с ХСН из-за низкого уровня давления, имеются серьезные
возражения. Специальные исследования показали, что даже крайне
малые дозы ИАПФ (например, 1,56 мг каптоприла или 1/16 стандартной
таблетки в 25 мг) позволяют преодолевать рефрактерность к мочегонным
и постепенно выводить пациентов из критического состояния (Motwani
и соавт.,1992).
<Поздняя> рефрактерность к лечению мочегонными
развивается спустя несколько месяцев непрерывного лечения и связана
с гипертрофией эпителиальных клеток в ответ на постоянно повышенную
абсорбцию электролитов (Kramer и соавт.,1999).
Рис. 53. Плотность
альфа1 -, бета1 - и бета2 - рецепторов
в миокарде левого желудочка у больных в зависимости от наличия
ХСН
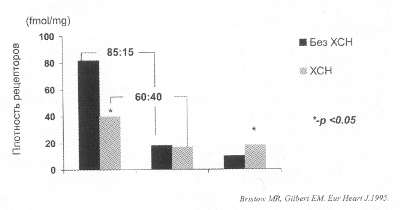
Рис. 54. Зависимость снижения риска смерти при лечении БАБ больных с разной тяжестью ХСН, определенной по показателю годичной смертности
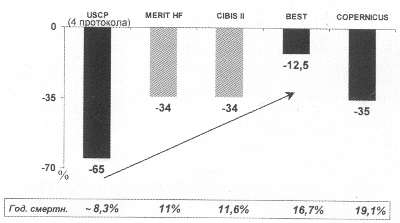
Рис. 55. Свойства и выведение из организма БАБ в зависимости от степени растворимости в жирах (липофильности)
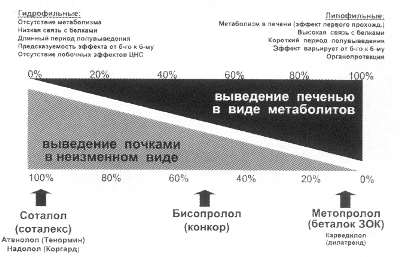
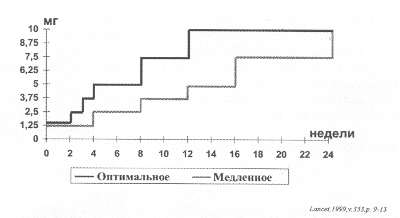
Рис. 56. Титрование дозировок бисопролола в исследовании CIBIS-II
5.2.7.2. Преодоление рефрактерности
к диуретикам
Для преодоления рефрактерности к лечению мочегонными средствами
необходимо применять комплекс методов.
1. Строгое ограничение приема соли (а не жидкости !).
2. Назначение мочегонных средств только внутривенно.
3. Применение высоких доз мочегонных. Имеются сообщения о преодолении
рефрактерности к терапии при назначении до
2000 мг лазикса. В особо сложных случаях рекомендуется болюсное
введение лазикса внутривенно в дозе 40-80 мг с последующим капельным
введением со скоростью 10-40 мг/ч в течение 48 ч.
4. Создание условий для нормализации давления:
- отказ от приема вазодилататоров, наиболее часто - это нитраты,
назначаемые без показаний, лишь из-за диагноза ИБС;
- при необходимости использование стероидных гормонов (преднизолон
внутривенно до 180 - 240 мг и перорально до 30 мг), кордиамина;
- в критических ситуациях применяется внутривенная капельная
инфузия допамина с <почечной> скоростью 0,5 - 2,0 мг/кг/мин,
длительностью до суток. В таком случае препарат за счет влияния
на допаминергические рецепторы изолированно увеличивает почечную
фракцию кровотока, клубочковую фильтрацию и несколько уменьшает
проксимальную реабсорбцию. При увеличении длительности введения
допамина, как и при повышении скорости инфузии, начинают преобладать
другие эффекты препарата (стимуляция бета 1- и затем альфа 1-
рецепторов), сопровождающиеся повышением АД и инотропного действия,
которые позволяют поддерживать приемлемый уровень клубочковой
фильтрации.
5. Нормализация нейрогормонального профиля (назначение ИАПФ
и антагонистов АЛД) также альдактона (верошпирона). Альдактон
(верошпирон) лучше назначать утром, во время максимального циркадного
подъема уровня АЛД в дозе 200 - 300 мг/сут. Необходимо помнить,
что назначенный перорально препарат начинает действовать лишь
на третьи сутки, поэтому в первые 2-3 дня альдактон лучше вводить
внутривенно.
6. Нормализация белкового профиля - применение альбумина (200
- 400 мл/сут) возможно вместе с диуретиками, что увеличивает скорость
их фильтрации.
7. При достаточном уровне АД возможно дополнительное назначение
препаратов, увеличивающих скорость клубочковой фильтрации (положительные
инотропные препараты, эуфиллин).
8. Комбинирование нескольких диуретиков. Мы уже говорили о
целесообразности сочетания активных диуретиков с ингибиторами
карбоангидразы, что позволяет избежать развития алкалоза, в условиях
которого ослабевает действие тиазидных и петлевых диуретиков.
Диакарб, во-первых, подкисляет мочу, а во-вторых, за счет нарушения
реабсорбции натрия в проксимальных канальцах сохраняет более высокую
концентрацию этого иона в первичной моче. Из-за этого восходящая
часть петли Генле в большей степени "загружается" ионами
натрия и увеличивается субстрат для действия петлевых и тиазидных
диуретиков.
Аналогично применение петлевых и тиазидных диуретиков усиливает
поступление ионов натрия в дистальные канальцы, где действуют
антагонисты альдостерона, и тем самым повышает эффективность применения
верошпирона.
Это важное правило: назначение любого мочегонного препарата
приводит к тому, что из-за нарушения реабсорбции натрия усиливается
"загрузка" этим ионом более дистальных частей нефрона.
В итоге потенцируется действие мочегонных препаратов, действующих
на низлежащие канальцы.
Рис. 57. Механизмы негативного
влияния гиперальдостеронизма при ХСН
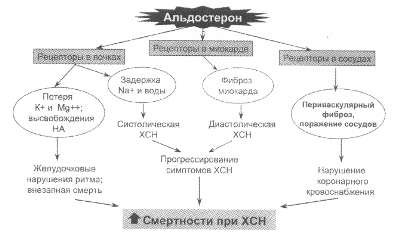
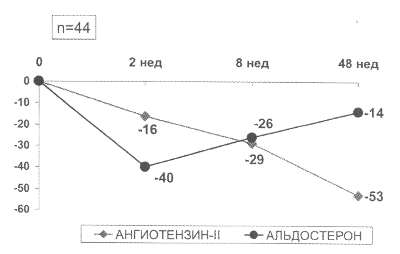
Рис. 58. "Ускользание" блокады синтеза альдостерона при длительном лечении больных с ХСН ИАПФ
5.2.8. Сочетанное применение
активных диуретиков
Формально все три наиболее часто назначаемых в России
петлевых диуретика - лазикс, урегит и буметанид - обладают высокой
и приблизительно одинаковой диуретической активностью. Хотя в
мире в настоящее время большое количество исследований рекомендует
к применению относительно новый и, судя по литературе, наиболее
сильный петлевой диуретик - торасемид, достаточного опыта по использованию
этого препарата в России нет. Более того, в сознании отечественных
врачей-терапевтов три петлевых диуретика ранжированы как наиболее
сильные и часто применяемые - первый -фуросемид, второй - урегит
и третий, самый слабый - буметанид (буфенокс). Как уже говорилось
выше, это не соответствует действительности. Недостатком урегита
является отсутствие внутривенной формы. А вот буметанид имеет
даже преимущества перед фуросемидом в фармакодинамике.
Тем не менее в реальной жизни устойчивость к лечению мочегонными
определяется докторами при недостаточном мочегонном эффекте относительно
высоких (до 240 мг внутривенно) доз лазикса. Оставляя в стороне
дискуссию об истинности такой "рефрактерности" к лечению,
можно констатировать, что подобная клиническая ситуация требует
сочетания активных диуретиков.
Исходя из изложенного правила, выгодным является сочетание
петлевых диуретиков с тиазидными, которые блокируют реабсорбцию
натрия на различных участках нефрона. Эта комбинация более оправдана,
чем применение сочетания двух петлевых диуретиков (например, фуросемида
с урегитом или буфеноксом). Конечно, и комбинация двух петлевых
диуретиков может позволить преодолеть толерантность к длительному
использованию одного из них, но тиазидные диуретики действуют
на более дистальные отделы нефрона и при комбинации лазикс + гипотиазид
зона блокады реабсорбции натрия в канальцах расширяется. Кроме
того, такая комбинация влияет на два различных транспортера электролитов
в апикальных клетках канальцев.
Наиболее популярной в мире является комбинация лазикса с метолазоном.
Как уже упоминалось, метолазон - самый липофильный и длительно
действующий тиазидный диуретик, что обеспечивает дополнительную
эффективность указанной комбинации, особенно при нарушении функции
почек. Однако и сочетание петлевого диуретика (чаще всего лазикса)
с гипотиазидом и, вероятно, с индапамидом (к сожалению, этот диуретик
при ХСН не исследован) тоже может повысить эффективность дегидратационной
терапии.
Таким образом, оптимальный принцип сочетанной диуретической
терапии при рефрактерном отечном синдроме у больных с ХСН подразумевает
сочетание высоких доз лазикса, вводимого внутривенно, с тиазидным
диуретиком и верошпироном, а 1 раз в 2 нед к терапии следует добавлять
на 3-4 дня ингибитор карбоангидразы (диакарб).
В заключение следует
отметить, что даже подобные меры не всегда позволяют преодолеть
устойчивость к дегидратационной терапии. Тогда приходится прибегать
к механическому удалению избыточной жидкости из полостей (плевральная,
перикардиальная пункция и парацентез) или экстракорпоральным методам
дегидратации (изолированная ультрафильтрация, гемодиализ).
Рис. 59. Изменение
регуляции синтеза альдостерона при ХСН
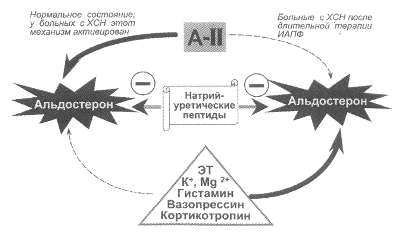
Рис. 60. Побочные эффекты диуретиков, связанные с активацией гормонов
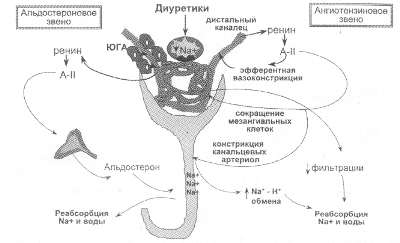
Рис. 61. Динамика выживаемости больных с ХСН при лечении ИАПФ и их комбинацией с БАБ
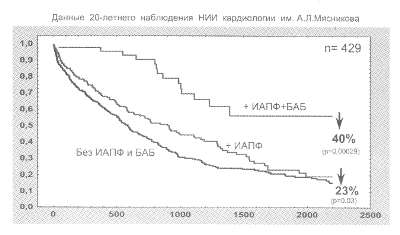
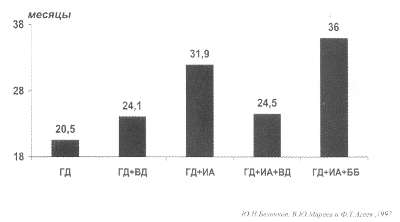
Рис. 62. Средняя длительность дожития больных с ХСН в зависимости от типа проводимой терапии
5.2.9. Изолированная ультрафильтрация
как метод дегидратационной терапии при ХСН
Изолированная ультрафильтрация - это экстракорпоральный
метод лечения, основанный на удалении избыточной части плазмы
для уменьшения объема циркулирующей крови (ОЦК), а затем и отеков.
Кровь из крупной вены забирается в аппарат для гемодиализа и пропускается
под давлением через мелкопористую мембрану, пропускающую
жидкость, но не пропускающую белки. В итоге избыточное количество
плазмы удаляется, а <сухой> остаток возвращается через другую
вену в кровеносное русло. Поскольку белки не проходят через мембрану,
онкотическое давление повышается и жидкость из тканей начинает
идти в сосудистое русло, из которого она продолжает удаляться.
Достоинства ультрафильтрации:
- эффективна при рефрактерности к мочегонным;
- позволяет дозированно удалять нужное количество жидкости;
- не теряется белок;
- не повышается, а в ряде случаев снижается уровень гормонов
(АЛД), что не сопровождается <рикошетной> задержкой натрия.
К недостаткам ультрафильтрации относится ее <резкость>
по отношению к нежным пациентам с ХСН. После неадекватного (по
количеству и темпу) удаления жидкости происходит мощная вазоконстрикция,
которая затрудняет деятельность сердца и при критическом снижении
сократимости может быть непреодолимым барьером. После первых сеансов
ультрафильтрации отмечаются случаи нарушения микроциркуляции.
В итоге положительный эффект ультрафильтрации равняется 58%, а
летальность больных в процессе курса терапии составляет 18%.
Противопоказаниями к проведению ультрафильтрации являются:
- гипотония,
- стенозы клапанных отверстий,
- наличие внутрисердечных тромбозов.
Лучше всего придерживаться правила по возможности не прибегать
к диализным методам удаления избыточной жидкости у больных с ХСН.
Если же вынужденно используется ультрафильтрация, нужно выполнять
минимальное количество процедур с минимальной скоростью удаления
жидкости. При восстановлении чувствительности к мочегонным немедленно
переходить на дегидратационное медикаментозное лечение.
5.3. Положительные инотропные средства (сердечные гликозиды)

5.3.1. История вопроса
Как уже говорилось выше, при рассмотрении теорий патогенеза
ХСН во все периоды несомненным казался один постулат - слабость
сердечной мышцы и снижение СВ (насосной функции сердца) является
одной из ведущих причин развития декомпенсации и застойных явлений
в организме. Более чем 200-летняя история успешного применения
сердечных гликозидов, казалось, подтверждала эту теорию: клиническая
эффективность препаратов дигиталиса не вызывала сомнения и они
оставались средством < 1 в лечении декомпенсации. Правда, к
группе положительных инотропных средств гликозиды окончательно
были причислены лишь в 60-х годах ХХ века. Кроме того, никаких
длительных плацебо-контролируемых исследований с сердечными гликозидами
и оценкой их влияния на прогноз и выживаемость больных с ХСН до
80-х годов XX века не проводилось. Иными словами, с точки зрения
<медицины доказательств> гликозиды не отвечали требованиям,
необходимым для их использования в качестве основных средств лечения
декомпенсации.
Однако эти возражения не являлись предметом дискуссий. В середине
80-х годов двумя основными недостатками сердечных гликозидов
считались их слабый (недостаточный)
положительный инотропный эффект и узкий терапевтический диапазон
действия, что сопровождалось частым развитием опасных побочных
реакций (гликозидной интоксикации). Т.е. "кнут"
казался недостаточно сильным.
Сама гипотеза целесообразности инотропной стимуляции сердца
не вызывала сомнений. Казалось, стоит синтезировать более мощные
инотропные агенты, не вызывающие побочных реакций, свойственных
сердечным гликозидам, и задача будет решена.
5.3.2. Механизм сократимости и расслабления кардиомиоцитов
На рис. 34 схематично представлены разные пути усиления
сократимости сердечной мышцы. Как известно, сила сокращения зависит
от степени взаимодействия двух основных сократительных белков
- актина и миозина. Для того, чтобы нити актина и миозина могли
свободно скользить вдоль друг друга, а КМЦ сокращаться (показано
звездочкой), необходимо устранить препятствие в виде тропомиозина.
Высвобождающийся из саркоплазматического ретикулума (СР) кальций
(Са2+) разрушает тормозящий комплекс тропонин - тропомиозин,
связывается с тропонином Ц (ТНЦ) и катализирует сокращение. После
этого кальций удаляется в СР, вновь образуется блокирующий комплекс
тропонин-тропомиозин, прекращается скольжение нитей актина и миозина
и наступает расслабление. Считается, что некоторые из девяти изоформ
протеинкиназы Ц (ПКЦ) также играют роль в усилении взаимодействия
актина и миозина, а значит и сокращения.
Как видно, ионы кальция, мобилизующиеся из СР, играют основную
роль в процессах сокращения. Это универсальный внутриклеточный
мессенджер и своеобразный катализатор реакции сокращения. Схематично
весь процесс изложен на рис. 35. Достаточная концентрация ионов
кальция при соединении с ТНЦ блокирует торможение реакции между
сократительными белками. Образуются устойчивые мостики между актином
и миозином, что получило название сильной связи. Этот процесс
при участии макроергических соединений (АТФ) приводит к сокращению
(систоле).
В дальнейшем молекулы АТФ, превращаясь в АДФ и отдавая свою
энергию, вызывают конформацию головок миозина, нарушая устойчивость
мостиков между сократительными белками даже при сохранной концентрации
кальция. Эта ситуация получила название слабой связи между актином
и миозином. Сила сокращения ослабевает.
Затем, за счет энергии, возникающей при фосфорилировании АТФ,
кальций удаляется в СР, его концентрация снижается и происходит
расслабление (диастола). Таким образом,
все фазы сердечного цикла связаны с движением кальция и обеспечиваются
за счет энергии макроэргических соединений (АТФ). Синтез АТФ
из ацетил коэнзима А происходит в основном в митохондриях (рис.
36). Как видно, имеются два основных пути синтеза макроэргических
соединений - глюкозозависимый (левая цепочка) и свободножирнокислотный
- СЖК (правая цепочка).
Как видно, энергетически более выгодным является преимущественно
аэробный глюкозозависимый путь, позволяющий синтезировать 6,6
молекулы АТФ в расчете на условную единицу кислорода. В этом случае
синтез АТФ происходит как за счет гликолиза, так и за счет окислительного
декарбоксилирования пирувата. Принципиальным ферментом этой цепочки
является пируватдегидрогеназа (ПДГ).
СЖК в основном анаэробный путь, экономически менее выгоден,
так как при использовании одной условной единицы кислорода образуется
на 20% АТФ меньше (5,6 молекулы). Принципиальным ферментом этой
цепочки является 3 - кетоацил- коэнзим А-редуктаза, осуществляющая
бета-окисление СЖК. В норме два различных пути образования АТФ
находятся в состоянии относительного равновесия. Притом они находятся
в антагонистической зависимости - при усилении каждой из цепочек
синтеза АТФ вторая начинает подавляться (см. рис. 36). Как видно,
при ХСН и гипоксии миокарда начинает преобладать экономически
менее выгодный путь образования энергии - СЖК и подавляется глюкозозависимый.
В итоге происходит уменьшение синтеза макроэргических соединений
параллельно с развитием ацидоза клеток и нестабильности клеточных
мембран.
В последние годы активно исследуются препараты, позволяющие
перераспределить образование энергии в клетке от СЖК к энергетически
более выгодному глюкозозависимому пути. Этот класс лекарств получил
название цитопротекторов и активно исследуется, в том числе и
у больных с ишемической кардиомиопатией и признаками декомпенсации.
Речь идет о блокаторе фермента 3 кетоацил-коэнзим А тиолазы триметазидин
(предуктал). Дальнейшие исследования подтвердят, обоснованы
ли наши надежды на появление нового направления в возможном лечении
декомпенсации - нормализации метаболизма кардиомиоцитов.
Поскольку, как мы говорили выше, АТФ играет важную роль в обеспечении
как сокращения, так и расслабления кардиомиоцитов, то при ХСН
страдают все фазы сердечного цикла. Однако не только уменьшение
синтеза АТФ приводит к нарушениям функции КМЦ при ХСН. Нарушается
и функционирование СР и существенно замедляется движение ионов
кальция, основного стимулятора сокращения через каналы СР. В итоге
нарушается сила сокращения миокарда (систолическая дисфункция)
и степень его расслабления (диастолическая дисфункция). Вначале
избыточный ток ионов кальция внутрь клетки, связанный с влиянием
основных нейрогормонов на альфа- и бета- рецепторы КМЦ, пытается
компенсировать нарушенную сократимость. При этом все больше нарушается
диастолическое расслабление. Однако постепенно плотность и аффинность
рецепторного аппарата КМЦ нарушается. В более поздней стадии переполненные
кальцием КМЦ практически перестают отвечать на внешние стимулы
(катехоламины, А II, эндотелин и др.). Эта ситуация проиллюстрирована
на рис. 37. Как видно, сократимость КМЦ в ответ на стимуляцию
бета-рецепторов добутамином существенно меняется в зависимости
от выраженности ХСН. При тяжелой декомпенсации с ФВ < 25% положительный
инотропный эффект в ответ на введение добутамина резко ослабляется
(левая панель). В то же время введение кальция продолжает вызывать
прирост сократимости вне зависимости от степени поражения миокарда,
величины ФВ и степени ХСН. Подобный процесс ослабления действия
дериватов катехоламинов у пациентов с тяжелой ХСН получил название
<десенситизации>. Это понятие включает в себя и уменьшение
плотности бета-рецепторов и их чувствительности к катехоламинам,
и разобщение между стимуляцией рецепторов и
функционированием аденилатциклазы (АЦ). В итоге развиваются типичные
для ХСН изменения КМЦ, получившие название кардиомиопатии перегрузки
(A.Katz, 1990). Более подробно о роли гиперактивации САС в развитии
кардиотоксичности см. раздел 5.4.1.
5.3.3. Классификация положительных инотропных средств
Принцип создания положительных инотропных препаратов,
способных усиливать сокращение сердечной мышцы, так или иначе
связан с воздействием на внутриклеточный кальций, как универсальный
вторичный мессенджер.
В 70-90-е годы было синтезировано много химических соединений
(часть из них стала препаратами), усиливающих силу сокращения
мышечных волокон и получивших в отличие от сердечных гликозидов
название негликозидные инотропные стимуляторы.
Принципиально на сегодняшний день эксплуатируются пять основных
возможностей повышения сократимости и соответственно этому созданы
или создаются положительные инотропные средства (табл. 6).
Как видно, в реальной клинической практике для длительного
лечения ХСН сегодня применяются
лишь сердечные гликозиды. Стимуляторы бета1-рецепторов (НА, изопротеренол
= изадрин, добутамин и допамин) применяются в основном внутривенно
в острых клинических ситуациях. То же самое относится и к ингибиторам
ФДЭ (амринон и милринон). Сенситизатор кальция левосимендан находится
в процессе исследований.
Однако, поскольку попытки создания новых инотропных препаратов
обязательно будут продолжены, идея стимуляции насосной функции
сердца продолжает пользоваться поддержкой у многих практикующих
врачей, а также потому, что эти вопросы
систематически никогда не излагались в нашей литературе, мы решили
обсудить их более подробно.
5.3.3.1. Увеличение транспорта кальция через мембрану
клетки путем воздействия на электролитные насосы (ионообмен)
Из препаратов первой группы наиболее
популярными являются, конечно, сердечные гликозиды, механизм действия
которых обозначен цифрой 1 на рис. 34 на стр. 108. Как видно,
основной эффект сердечных гликозидов - это блокада активности
натрий - калиевой АТФазы (НКА). За счет этого замедляется ионообмен
калия на натрий. Нарушения выведения натрия из клетки способствуют
усилению деятельности натрий-кальциевого обмена (НКЦО), что сопровождается
повышенным входом кальция в клетку. Больше кальция попадает в
СРК и в итоге по механизму, изложенному выше, усиливается сократимость.
5.3.3.2. Увеличение транспорта кальция через мембрану
клетки путем воздействия на электролитные каналы
Теоретически аналогичное увеличение входа кальция в клетку
может быть достигнуто за счет стимуляции функционирования натриевых
каналов (показано цифрой 2) или блокадой выхода калия из клетки
(показано цифрой 3). Из препаратов, применявшихся в клинике, свойствами
влиять на натриевые и особенно блокировать калиевые каналы обладал
препарат веснаринон (производное квиналона, обладавшее свойствами
ингибитора ФДЭ).
Возможно и прямое усиление входа кальция в клетку путем активации
кальциевых каналов. В эксперименте исследовался препарат BAY K
8644, но в клиническую практику он не вошел (цифра 4 на рис. 34
на стр. 108).
5.3.3.3. Увеличение транспорта кальция через саркоплазматическую
мембрану путем воздействия на аденилатциклазный (АЦ) механизм
Это второй, наиболее популярный путь усиления сократимости.
Как видно из рис. 34, возможны три точки приложения действия препаратов
с положительным инотропным действием на этом пути. Первое - это
стимуляция бета-адренорецепторов (показано цифрой 5). О соотношении
двух типов бета-рецепторов в нормальном миокарде и при ХСН см.
подробнее раздел 5.4.1. При этом активируются G белки клеточной мембраны и
происходит передача сигнала на АЦ. Происходит образование циклического
АМФ (цАМФ), который стимулирует мобилизацию кальция из СР. В итоге
происходит усиление сокращения. К препаратам с подобным действием
можно отнести дериваты катехоламинов. Классической субстанцией,
стимулирующей бета-рецепторы, является изопротеренол (изадрин).
В практике наиболее активно применяются естественный предшественник
синтеза катехоламинов допамин и синтетический препарат добутамин,
представляющий собой практически удвоенную молекулу допамина.
Особенностью этой группы препаратов является их действие на
разные типы рецепторов, что показано в табл. 7.
Положительное ино- и хронотропное действие осуществляется за
счет стимуляции бета1-рецепторов (при ХСН частично и за счет бета2)
КМЦ. В то время как воздействие на бета2-рецепторы обеспечивает
бронходилатацию и расширение периферических сосудов, стимуляция
альфа1-рецепторов - мощную вазоконстрикцию. Об особенностях стимуляции
допаминергических рецепторов при введении допамина, позволяющих
улучшать почечный кровоток и фильтрацию, говорилось в предыдущем
разделе. Поэтому положительное инотропное действие дериватов катехоламинов
- это лишь один из эффектов, который часто может дополняться другими,
нередко осложняющими их использование при ХСН.
Другими возможностями на пути увеличения сократимости, связанными
с образованием цАМФ, может быть прямая стимуляция АЦ-механизма
(показано цифрой 6 на рис. 34 на стр. 108) и нарушение распада
цАМФ (показано цифрой 7 на рис. 34). Препаратом, стимулирующим
активность АЦ, является форсколин, который, однако, никогда не
применялся в клинической практике из-за высокой токсичности. А
вот группа лекарств, блокирующих фермент ФДЭ, особенно его III изоформу, и нарушающих деградацию цАМФ, получила широкое
распространение. Основными ингибиторами ФДЭ III являются препараты
амринон и милринон. Эти препараты, блокируя III изоформу ФДЭ,
не только уменьшают деградацию цАМФ в кардиомиоцитах, но и повышают
образование циклического гуанозинмонофосфата (цГМФ) в гладкомышечных
клетках периферических сосудов. За способность повышать сократимость
миокарда и одновременно расширять (дилатировать) сосуды, ингибиторы
ФДЭ получили название <инодилататоры>. Такой механизм действия
выглядит идеальным с позиций патогенеза ХСН, и эти средства в
начале 90-х годов считались наиболее перспективными для лечения
ХСН. Хотя затем их длительное применение при ХСН к успеху не приводило.
5.3.3.4. Увеличение транспорта кальция через саркоплазматическую
мембрану путем воздействия на фосфоинозитольный механизм
Иной (кроме цАМФ) системой внутриклеточной регуляции сократимости
клеток является так называемый фосфоинозитольный путь. Как видно
из рис. 34, стимуляция альфа1-рецепторов КМЦ (в организме на эти
рецепторы мощно влияет НА, а также А II и эндотелин) приводит
к целому каскаду взаимодействий. Во-первых, активируется фермент
фосфолипаза Ц (ФЛЦ), которая воздействует на начальное звено фосфоинозитольного
каскада - фосфоинозитол-бифосфат (ФИБФ). Затем ФИБФ распадается
на два вторичных соединения инозитолтрифосфат (ИТФ) и диацилглицерол
(ДАГ). ИТФ через влияние на специфические рецепторы стимулирует
мобилизацию ионов кальция из СР, что, как мы обсуждали выше, усиливает
сократимость. Более липофильный продукт стимуляции фосфоинозитольного
пути ДАГ, располагаясь на внутренней поверхности мембраны клетки,
активирует ПКЦ, одной из функций которой также является увеличение
инотропизма КМЦ.
Таким образом, активация фосфоинозитольного каскада стимулирует
сократимость не только за счет активации транспорта кальция, что
отличается от трех основных механизмов повышения сократимости,
обсуждавшихся выше. Однако специфических препаратов с направленным
действием на различные компоненты этой системы внутриклеточных
вторичных мессенджеров в клинике нет. Можно упомянуть альфа1-агонисты,
к которым относятся уже упоминавшиеся НА, допамин и синтетический
препарат мезатон. Однако их влияние на альфа1-рецепторы периферических
сосудов гораздо более выражено и вазоконстрикция развивается раньше,
чем повышение сократимости (показано цифрой 8 на рис. 34 на стр.
108). Поэтому эти средства (особенно НА и мезатон) чаще применяют
при шоке и критическом снижении АД. К препаратам, специфически
блокирующим фермент инозитолтрифосфат- протеинкиназу Ц и уменьшающим
деградацию ИТФ, относился флозеквинан. Этот очень интересный положительный
инотропный агент с одновременным вазодилатирующим действием активно
исследовался, в том числе и в России (точка приложения его действия
показана цифрой 9 на рис. 34). Но, несмотря на хорошие результаты
курсового лечения больных с ХСН, флозеквинан негативно влиял на
выживаемость пациентов с ХСН и в связи с этим был изъят из клинической
практики. Однако и этот препарат оказывал положительное инотропное
действие за счет стимуляции транспорта кальция через саркоплазматическую
мембрану.
Таким образом, несмотря на разные механизмы действия, все
препараты четырех групп оказывают положительный инотропный эффект
через стимуляцию транспорта ионов кальция через клеточную или
саркоплазматическую мембрану.
Недостатком всех инотропных препаратов, влияющих на трансмембранный
ток электролитов КМЦ, является способность изменять вне- и внутриклеточный
баланс кальция, калия, натрия, магния и водорода, что чревато
развитием нарушений ритма сердца, ацидоза и гибелью сократительных
клеток миокарда. В этом видится и механизм развития наиболее известного
осложнения терапии инотропными средствами - гликозидной интоксикации.
