Терапия-Оценка жизнеспособности миокарда у больных с выраженной дисфункцией левого желудочка и хронической недостаточностью кровообращения на фоне медикаментозного лечения с использованием beta-блокаторов и ИАПФ
Оценка жизнеспособности миокарда у больных с выраженной дисфункцией левого желудочка и хронической недостаточностью кровообращения на фоне медикаментозного лечения с использованием beta-блокаторов и ИАПФ
М.А.Саидова, Ю.Н.Беленков, В.Ю.Мареев, В.Б.Сергиенко, Е.Н.Ходарева
НИИ кардиологии им. А.Л.Мясникова РКНПК Минздрава РФ, Москва
URL
Резюме
Целью нашего исследования явилось изучение возможности
восстановления сократимости жизнеспособного миокарда у больных
с выраженной дисфункцией левого желудочка и хронической сердечной
недостаточностью на фоне медикаментозного лечения.
Материал и методы. У 31
больного ИБС с постинфарктным кардиосклерозом и 34 больных ДКМП
(ФК НК ср.
2,7 ± 0,4 по NYHA) проведена оценка жизнеспособности миокарда с помощью
добутаминовой стресс-ЭхоКГ и перфузионной сцинтиграфии миокарда.
По результатам обследования пациентов разделили на больных ИБС
с наличием и отсутствием признаков жизнеспособности диссинергичного
миокарда, а также больных ДКМП с высоким и низким резервом глобальной
сократимости при пробе с добутамином. В течение 6 мес всем больным
назначали медикаментозную терапию: 1-я группа (13 больных ИБС
и 15 – ДКМП) получала эналаприл, 2-я группа (8 больных ИБС и 9
– ДКМП) принимала карведилол и 3-я группа (8 больных ИБС и 9 –
ДКМП) получала эналаприл в сочетании с бисопрололом. Группы больных
после рандомизации были сопоставимы по этиологии, тяжести заболевания,
полу и возрасту.
Результаты исследования. На фоне медикаментозной терапии только
в группах больных ИБС с наличием жизнеспособного миокарда и больных
ДКМП с высоким резервом глобальной сократимости отмечались прирост
ФВ ЛЖ (p < 0,001), а также уменьшение КСО ЛЖ (p < 0,01)
и ФК НК (p < 0,05). Наиболее существенными эти изменения наблюдались
при назначении комбинации эналаприла с бисопрололом. Сравнительная
оценка эффективности медикаментозного лечения больных ИБС и ДКМП
показала, что более выраженное положительное влияние терапии на
изучаемые показатели отмечалось в группе больных ДКМП с высоким
резервом сократимости, наименьшая – у больных с низким резервом
сократимости. Промежуточное положение в этом ряду занимали больные
ИБС с наличием и отсутствием жизнеспособного миокарда в зонах
диссинергии.
Заключение. Медикаментозная терапия может быть эффективной в лечении
гибернирующего миокарда у больных с выраженной дисфункцией левого
желудочка и в ряде случаев использована для поддержания жизнеспособности
диссинергичного миокарда до проведения мероприятий по восстановлению
нарушенного кровотока.
Ключевые слова: жизнеспособный миокард, гибернирующий
миокард, медикаментозное лечение, выраженная дисфункция левого
желудочка.
This study was undertaken to study
whether contractility of the viable myocardium can be restored
in patients with significant left ventricular dysfunction and
chronic heart failure by drug therapy.
Materials and methods. Dobutamine stress echocardiography
and myocardial perfusion scintigraphy were used to evaluate myocardial
viability in 31 patients with coronary heart disease (CHD) and
postinfarction cardiosclerosis and 34 patients with dilated cardiomyopathy
(DCMP) [NYHA functional class heart failure (FC HF), mean 2.7±0.4].
According to the results of examination, the patients were divided
into those having CHD with or without signs of the viability of
the dyssynergic myocardium and into those having DCMP with a high
or low reserve of global contractility during the dobutamine test.
During 6 months, all the patients have drug therapy: Group 1 (13
patients with CHD and 15 with DCMP) received enalapril, Group
2 (8 patients with CHD and 9 with DCMP) did carvedilol, and Group
3 (8 patients with CHD and 9 with DCMP) took enalapril in combination
with bisoprolol. After randomization, the groups were compared
by the etiology and severity of disease, gender, and age.
Results. After drug therapy, only groups of
CHD patients with the viable myocardium and DCMP patients with
a high reserve of global contractility showed an increase in left
ventricular ejection fraction (p < 0.001) and reductions in
left ventricular end systolic volume (p < 0.01) and FC HF (p
< 0.05). These changes were greatest when enalapril was used
in combination with bisoprolol. Comparative evaluation of the
efficiency of drug therapy in patients with CHD or DCMP showed
that the impact of the therapy was more significant in DCMP patients
with a high reserve of contractility and the least in those with
its low reserve. CHD patients with or without the viable myocardium
in the dyssynergic areas were intermediate.
Conclusion. Drug therapy may be effective in
the treatment of the hybernating myocardium in patients with significant
left ventricular dysfunction and occasionally useful in maintaining
dyssynergic myocardial viability before recovering impaired flow
blood flow.
Key words: viable myocardium, hybernating
myocardium, drug treatment, significant left ventricular dysfunction.
Нарушение сегментарной сократимости
(диссинергия) миокарда при ИБС может быть обусловлено не только
некрозом или рубцовым поражением. В тех случаях, когда диссинергия
носит обратимый характер, причиной ее возникновения служит ишемия
или гипоксия миокарда. Состояния потенциально обратимой миокардиальной
дисфункции получили названия "гибернации" и "оглушенности" миокарда.
Особенностью этого так называемого жизнеспособного миокарда является
сохранение клеточного метаболизма и резерва сократимости, позволяющее
выявлять его с помощью различных методов диагностики [1].
Оценка жизнеспособности
диссинергичного миокарда наиболее показана пациентам с тяжелой
дисфункцией левого желудочка. Больные ИБС с выраженным нарушением
сократимости миокарда и признаками его жизнеспособности демонстрируют
возрастание сократительной функции после реваскуляризации [2,
3]. Улучшение левожелудочковой функции ассоциируется с уменьшением
симптомов стенокардии, сердечной недостаточности и увеличением
продолжительности жизни [4, 5].
Несмотря на то
что основным и наиболее эффективным методом лечения гибернирующего
миокарда является эндоваскулярная или хирургическая реваскуляризация
миокарда, многие больные вынуждены отказываться от нее в силу
разных причин. В связи с этим вопросы медикаментозного лечения
гибернирующего или "спящего" миокарда являются весьма актуальными.
Механизмы влияния медикаментозной терапии на "спящий" миокард
остаются малоизученными. Предполагается, что медикаментозное лечение
должно быть направлено на поддержание жизнеспособности диссинергичного
миокарда до проведения мероприятий по устранению причин развития
гибернации [6, 7]. Первые сообщения о возможности применения b-адреноблокаторов и ингибиторов АПФ в лечении гибернирующего
миокарда были сделаны еще в начале 80-х годов [6, 8]. В последующем
появились данные об обоснованности применения антагонистов Са+2,
препаратов улучшающих метаболизм клеток, антиоксидантов [3, 7].
Поиск новых лекарственных средств, способных поддержать жизнедеятельность
"спящих" кардиомиоцитов, продолжается до настоящего времени.
Таблица 1. Клиническая характеристика обследованных больных
(М ± м)
|
Показатель |
Эналаприл |
Карведилол |
Эналаприл + Бисопролол |
|||
|
ИБС |
ДКМП |
ИБС |
ДКМП |
ИБС |
ДКМП |
|
|
Всего больных |
13 |
15 |
10 |
10 |
8 |
9 |
|
Возраст, годы |
55,2 ± 6,0 |
48,8 ± 8,6 |
50,8 ± 7,4 |
45,4 ± 8,3 |
52,9 ± 4,2 |
52,0 ± 6,7 |
|
Мужчины/женщины |
12/1 |
14/1 |
9/1 |
9/2 |
8/0 |
9/0 |
|
ФК НК |
2,7 ± 0,4 |
2,7 ± 0,4 |
2,6 ± 0,5 |
2,6 ± 0,5 |
2,7 ± 0,2 |
2,8 ± 0,3 |
|
ФВ ЛЖ, % |
30,8 ± 4,0 |
28,2 ± 4,2 |
30,7 ± 4,2 |
30,9 ± 3,9 |
28,1 ± 1,4 |
27,3 ± 3,7 |
|
Син.ритм/мерц. аритм. |
10/3 |
9/6 |
8/2 |
6/4 |
7/2 |
6,3 |
В отличие от ИБС
нарушение сократимости миокарда у больных дилатационной кардиомиопатией
(ДКМП) носит преимущественно диффузный характер. Интерес к исследованию
жизнеспособности миокарда у этих больных обусловлен в первую очередь
наличием выраженной диссинергии миокарда, приводящей к развитию
тяжелой сердечной недостаточности, а также указанием на имеющиеся
нарушения в системе коронарного кровоснабжения, не исключающие
возникновение гипоксического повреждения кардиомиоцитов [9–12].
Все вышеизложенное
создало предпосылки для проведения данного исследования, результаты
которого, возможно, будут способствовать разработке новых подходов
к лечению жизнеспособного миокарда.
Рис. 1. Изменение показателей центральной гемодинамики, ФК НК, региональной сократимости и перфузии миокарда у больных ИБС с наличием (1-я группа) и отсутствием (2-я группа) жизнеспособного миокарда на фоне терапии эналаприлом (I), карведилолом (II) и комбинации эналаприла с бисопрололом (III).
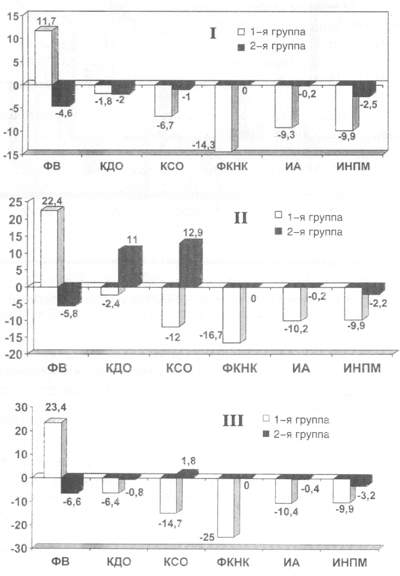
Рис. 2. Сравнительная оценка изменений показателей внутрисердечной гемодинамики, ФК НК, региональной сократимости и перфузии миокарда у больных ИБС на фоне терапии эналаприлом, карведилолом и комбинации эналаприла с бисопрололом.
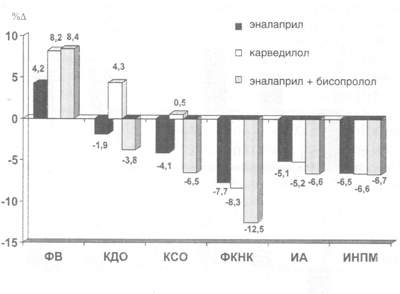
Рис. 3. Изменение показателей центральной гемодинамики, ФК НК, региональной сократимости и перфузии миокарда у больных ДКМП на фоне терапии эналаприлом (I), карведилолом (II) и комбинации зналаприла с бисопрололом (III)
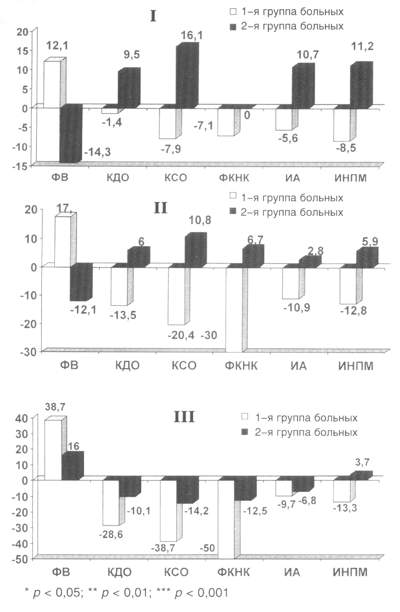
Рис. 4. Сравнительная оценка изменений показателей внутрисердечной гемодинамики, ФК НК, региональной сократимости и перфузии миокарда у больных ДКМП на фоне терапии эналаприлом, карведилолом и комбинации эналаприла с бисопрололом.
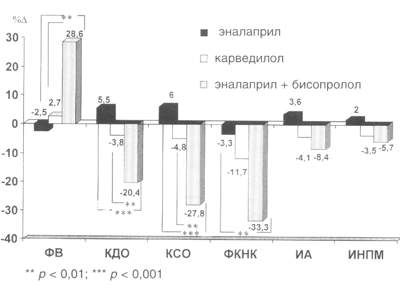
Рис. 5. Изменение показателей внутрисердечной гемодинамики и НК у больных ИБС и ДКМП на фоне медикаментозной терапии
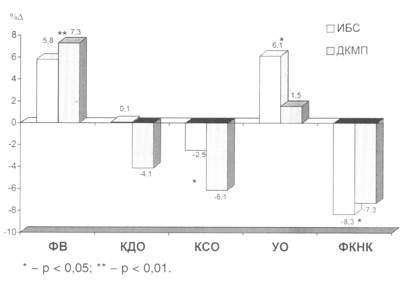
Рис. 6. Сравнительная оценка влияния медикаментозного лечения на показатели ФК НК и систолической функции левого желудочка у больных ИБС с наличием и отсутствием жизнеспособного миокарда и больных ДКМП с высоким и низким резервом сократимости на добутамине.
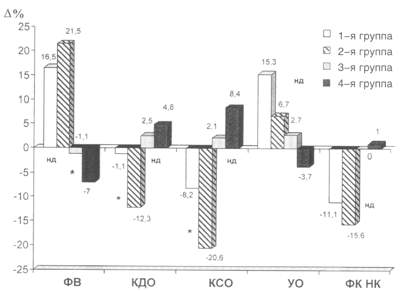
1-я группа – больные ИБС с наличием жизнеспособного миокарда (n = 16); 2-я группа – больные ИБС с отсутствием жизнеспособного миокарда (n = 15); 3-я группа – больные ДКМП с высоким резервом глобальной сократимости на добутамине (n = 17); 4-я группа – больные ДКМП с низким резервом глобальной сократимости на добутамине (n = 17).
Материал и методы
В исследование были включены 65 больных с хронической недостаточностью
кровообращения (ХНК) I–III функционального класса (ФК НК по NYHA),
находившихся на обследовании и лечении в НИИ кардиологии им. А.Л.Мясникова
РКНПК Минздрава РФ: из них 31 больной ИБС с постинфарктным кардиосклерозом
и 34 пациента с ДКМП. Критериями включения больных в исследование
кроме наличия клинических признаков ХНК, были расширение полости
левого желудочка более 6 см и фракция выброса левого желудочка
(ФВ ЛЖ) менее 40%. Диагноз во всех случаях устанавливали на основании
тщательного клинико-инструментального обследования больных, включая
коронароангиографию (КАГ). Клиническая характеристика больных
представлена в табл. 1.
На I этапе исследования
у всех больных оценивали жизнеспособность миокарда по данным стресс-ЭхоКГ
с добутамином (ДСЭ) и перфузионной сцинтиграфии миокарда (ПСМ).
Затем в течение 6 мес осуществляли медикаментозную терапию в рамках
двух исследовательских протоколов: 1-й – по сравнительной оценке
эффективности ингибитора АПФ эналаприла и неселективного b1,
2 и a1-адреноблокатора карведилола и 2-й – по сравнению эффективности
терапии больных с ХНК эналаприлом отдельно и в комбинации с селективным
b1- адреноблокатором бисопрололом.
Назначение исследуемых препаратов проводили на фоне подобранных
стабильных доз мочегонных средств и при необходимости сердечных
гликозидов. Двойным слепым способом больные были рандомизированы
в следующие группы: 1-я группа (13 больных ИБС и 15 больных ДКМП)
получала терапию эналаприлом – в среднем по 10 мг в сутки, 2-я
группа (10 больных ИБС и 10 больных ДКМП) принимала карведилол
в суточной дозе 25 мг и 3-я группа (8 больных ИБС и 9 больных
ДКМП) получала эналаприл в сочетании с бисопрололом в среднем
10 мг в сутки каждый препарат. Группы больных после рандомизации
были сопоставимы по этиологии и тяжести заболевания, полу и возрасту.
Алгоритм обследования и возможного восстановления
сократимости жизнеспособного миокарда
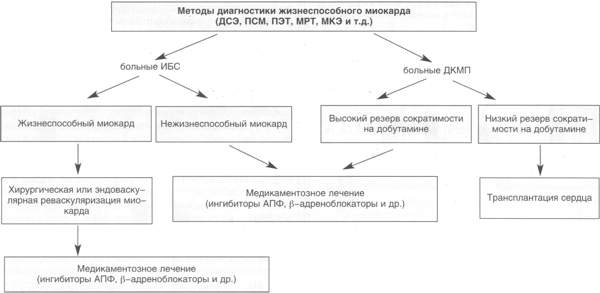
ДСЭ выполняли
по следующему протоколу: возрастающая инфузия добутамина от 5,
10, 15, 20... до 40 мкг/кг/мин по 3 мин каждая ступень с одновременным
мониторированием региональной, глобальной сократимости левого
желудочка, частоты сердечных сокращений (ЧСС), АД и ЭКГ. Критериями
прекращения нагрузки являлись: достижение субмаксимальной ЧСС,
развитие приступа стенокардии и/или ишемической динамики на ЭхоКГ
и ЭКГ, появление угрожающих нарушений сердечного ритма, повышение
АД более 220/120 мм рт.ст. и снижение АД более чем на 20 мм рт.ст.
от исходного. В течение всего исследования проводили непрерывную
запись ЭхоКГ на видеопленку. Компьютерную обработку серии ЭхоКГ
с возможностью одновременного выведения 4 изображений на экран
осуществляли на аппарате "Vingmed CFM 800" (Норвегия). Протокол
сцинтиграфического исследования включал проведение планарной сцинтиграфии
миокарда и однофотонной эмиссионной компьютерной томографии (ОЭКТ)
миокарда в покое и на высоте нагрузочной пробы. Регистрацию изображений
осуществляли на ротационной гамма-камере "Gammatome-2" (фирма
СGR, Франция) через 1–2 ч после введения 370–550 МБк технетрила
(99m Тс-метоксиизобутилизонитрила - МИБИ) в зависимости от массы
тела больного. Качественную и полуколичественную обработку полученных
данных проводили по стандартному пакету программ на компьютере
"Sophy" (фирма "Sophy Medical", Франция).
Анализ локальных нарушений сократительной функции и перфузии
миокарда проводили по 4-балльной шкале, унифицированной (для ДСЭ
и ПСМ) 16-сегментарной модели левого желудочка, где: 1 – нормокинезия;
2 – гипокинезия; 3 – акинезия; 4 – дискинезия по данным стресс-ЭхоКГ,
и 1 – нормальная аккумуляция радиофармпрепарата (РФП) с захватом
РФП более 75% от максимального включения в миокард; 2 – незначительные
или умеренно выраженные дефекты перфузии (от 50 и до 75% включения
изотопа); 3 – значительно выраженные дефекты перфузии (менее 50%
включения изотопа) и 4 – отсутствие или очень незначительное включение
изотопа в миокард (от 0 до 25%) по данным ПСМ. Для каждого больного
рассчитывали индекс асинергии (ИА) и индекс нарушения перфузии
миокарда (ИНПМ), которые являлись суммой баллов анализируемых
сегментов, разделенной на общее их количество.
В соответствии
с наличием или отсутствием признаков жизнеспособности диссинергичного
миокарда все больные ИБС были разделены на 2 подгруппы.
По данным ДСЭ критериями
жизнеспособности миокарда были: улучшение региональной сократимости
на 1 балл и более в двух соседних сегментах при введении малых
доз (5–10 мкг/кг/мин) добутамина или наличие двухфазного ответа
на возрастающее введение добутамина [13], а по результатам ПСМ
– включение РФП более 50% от максимального (2 балла и 1) [14].
Учитывая преимущественно диффузный характер нарушения сократимости
миокарда при ДКМП, пациенты с ДКМП были разделены на 2 подгруппы
в зависимости от величины резерва общей (глобальной) сократимости
левого желудочка в ответ на введение малых доз добутамина (фракция
выброса левого желудочка – ФВ ЛЖ): 1-я – больные с приростом ФВ
ЛЖ > 5% от исходного и 2-я – больные с приростом ФВ ЛЖ Ј 5%.
Результаты исследования обрабатывали с помощью статистических
пакетов программ: Microsoft Excel 7, Gpis, Origin. Данные представлены
в виде средних арифметических значений и ошибки средней величины
(М ± m).
Результаты исследования
1. Влияние медикаментозного лечения на функциональное состояние
миокарда больных ИБС с постинфарктным кардиосклерозом и ХНК в
зависимости от наличия или отсутствия жизнеспособного миокарда
У больных ИБС,
получавших эналаприл, в целом отмечался незначительный и недостоверный
прирост ФВ ЛЖ, уменьшение конечно диастолического объема (КДО),
конечного систолического объема (КСО), ФК НК, ИА и ИНПМ.
Анализ динамики этих параметров в двух подгруппах показал
(рис. 1), что под влиянием эналаприла только у пациентов с наличием
жизнеспособного миокарда отмечалось достоверное увеличение ФВ
ЛЖ и уменьшение ИА и ИНПМ. У больных с отсутствием признаков жизнеспособности
диссинергичных сегментов ФВ ЛЖ на фоне лечения даже несколько
снизилась, но снижение это было недостоверным.
Схожая картина
выявлялась и у больных ИБС, принимавших карведилол, при этом прослеживалась
тенденция к более выраженному положительному влиянию этого препарата
на некоторые параметры гемодинамики у пациентов с наличием жизнеспособного
миокарда.
Наибольшие же позитивные изменения показателей клинического
состояния, глобальной, региональной сократимости и перфузии миокарда
были выявлены у больных ИБС, получавших комбинацию эналаприла
с бисопрололом.
Сравнительная оценка влияния терапии эналаприлом, карведилолом
и комбинации эналаприла с бисопрололом на функциональное состояние
миокарда у больных ИБС в целом тем не менее не выявила достоверности
различий динамики изучаемых параметров (рис. 2).
Таким образом, эффективность медикаментозного лечения эналаприлом,
карведилолом и комбинации эналаприла с бисопрололом наиболее выражена
в группе больных ИБС с наличием жизнеспособного миокарда. Несмотря
на то что достоверного различия в изменении показателей клинического
состояния, глобальной, региональной сократительной функции и перфузии
миокарда на фоне терапии разными группами препаратов получено
не было, наибольшая положительная динамика их выявлялась в группе
больных, получавших комбинацию эналаприла с бисопрололом.
2. Оценка жизнеспособности
миокарда у больных ДКМП на фоне медикаментозного лечения
Влияние терапии
карведилолом, эналаприлом отдельно и в сочетании с бисопрололом
на показатели клинического состояния, внутрисердечной гемодинамики,
региональной сократимости и перфузии миокарда у больных ДКМП отражено
на рис. 3.
На фоне приема
эналаприла в группе больных ДКМП с относительно высоким резервом
глобальной сократимости (1-я группа) отмечалось достоверное увеличение
ФВ ЛЖ (p < 0,001), уменьшение ИА и ИНПМ (p < 0,05). Пациенты
с низким резервом глобальной сократимости (2-я группа) имели снижение
ФВ ЛЖ и возрастание показателей КДО, КСО, (p < 0,05), ФК НК
(нд), ИА и ИНПМ (p < 0,05) спустя 6 мес наблюдения.
Подобные изменения отмечались и у больных, получавших терапию
карведилолом, при этом обнаруживалась некоторая недостоверная
тенденция к более выраженному положительному влиянию этого препарата
на функциональное состояние миокарда больных ДКМП.
Наиболее же существенные изменения показателей внутрисердечной
гемодинамики у обследованных больных произошли на фоне терапии
эналаприлом с бисопрололом. Причем положительная динамика изучаемых
параметров отмечалась не только у пациентов с хорошим резервом
сократимости на добутамине, но и в целом у всех больных ДКМП,
получающих комбинированную терапию. В группе пациентов с низким
резервом сократимости изменения вышеперечисленных параметров были
недостоверными.
Сравнительная оценка влияния различных лекарственных препаратов
на параметры гемодинамики, сократительной функции, перфузии миокарда,
а также ФК НК больных ДКМП отражена на рис. 4.
Как видно на рис. 4, положительное воздействие комбинации
препаратов эналаприла с бисопрололом на параметры функционального
состояния миокарда больных ДКМП было более выраженным по сравнению
с влиянием монотерапии эналаприлом и карведилолом.
3. Сравнительная оценка медикаментозного лечения больных
ИБС и ДКМП
Сравнение эффективности общей медикаментозной терапии 34
больных ДКМП и 31 больного ИБС не выявило существенного достоверного
различия между ними при оценке динамики показателей ФВ ЛЖ, КДО,
КСО, ударного объема (УО) и ФК НК (рис. 5). Однако разделение
больных ИБС и ДКМП в зависимости от наличия или отсутствия признаков
жизнеспособности диссинергичного миокарда и от величины резерва
сократимости левого желудочка по данным ДСЭ показало, что наиболее
выраженное положительное влияние медикаментозной терапии на изучаемые
показатели наблюдалось в группе больных ДКМП с относительно высоким
резервом сократимости на малых дозах добутамина (3-я группа) (рис.
6). Наименьшая эффективность медикаментозной терапии отмечалась
у больных ДКМП с низким резервом глобальной сократимости (4-я
группа). Промежуточное положение в этом ряду занимали больные
ИБС с наличием и отсутствием жизнеспособного миокарда в зонах
диссинергии. Анализ динамики нарушений региональной сократимости
и перфузии миокарда выявил более существенное снижение ИА и ИНПМ
в двух группах больных ИБС. Ухудшение перфузии миокарда (возрастание
ИНПМ) за время 6-месячного наблюдения отмечалось только у больных
ДКМП с низким резервом сократимости миокарда на добутамине.
Таким образом,
положительное влияние медикаментозной терапии отмечалось у больных
ИБС с наличием жизнеспособного миокарда и у больных ДКМП с высоким
резервом общей сократимости левого желудочка по данным ДСЭ. Наилучшие
результаты медикаментозного лечения получены в группе больных
ДКМП с высоким резервом глобальной сократимости. Наиболее выраженная
отрицательная динамика изучаемых параметров выявлена у больных
ДКМП с низким резервом сократимости миокарда, что свидетельствует
о неэффективности медикаментозной терапии в этой группе больных.
Обсуждение результатов
Таким образом, полученные нами данные подтверждают мнение
о целесообразности применения ингибиторов АПФ и b-адреноблокаторов в лечении гибернирующего
миокарда у больных ИБС и ДКМП с ХНК. Положительные свойства ингибиторов
АПФ при лечении ХНК доказаны результатами многих крупных многоцентровых
исследований (CONSENSUS, SOLVD, V-HeFT II и др.), которые показали
достоверность уменьшения прогрессирования дилатации и гипертрофии
левого желудочка, а также приостановку процессов ремоделирования
на фоне терапии различными ингибиторами АПФ. Все это позволило
предположить возможность воздействия препаратов этой группы на
поддержание жизнеспособности и восстановление сократимости диссинергичного
миокарда. Ингибиторы АПФ предупреждают развитие миокардиального
фиброза, влияют на локальный синтез ангиотензина II непосредственно
в миокарде, уменьшают миокардиальный стресс и тем самым увеличивают
резерв миокардиальной сократимости.
Первые сообщения
о применении b-адреноблокаторов при лечении гибернирующего миокарда были
сделаны C.D.Furberg и S.Rahimtoola в конце 80-х годов [6, 7].
По данным этих авторов, наиболее эффективным лечение пропранололом
отмечалось в группе пациентов, имеющих клинические проявления
сердечной недостаточности. Использование b-адреноблокаторов в лечении больных с хронической сердечной
недостаточностью на первый взгляд выглядит необоснованным, так
как приводит к снижению сократимости кардиомиоцитов, однако уменьшение
потребления миокардом кислорода и переполнения кардиомиоцитов
кальцием приводит к улучшению диастолического расслабления миокарда
и возрастанию функционального резерва. Под влиянием b-адреноблокаторов происходит нормализация соотношения доставка/потребление
кислорода в кардиомиоцитах и часть из них, находящихся в состоянии
"спячки", оживает и включается в процесс сокращения. Таким образом,
после длительной терапии b-адреноблокаторами происходит рост сердечного выброса за
счет расширения зоны сокращающихся кардиомиоцитов. Это новое направление
в терапии болезней сердца получило название миокардиальной разгрузки
[15].
Поиск конкретных
лекарственных препаратов, способных пробудить "сон" гибернированных
кардиомиоцитов, представляет огромный интерес. В нашем исследовании
сравнивалось влияние двух разных b-адреноблокаторов карведилола и бисопролола, а также ингибитора
АПФ эналаприла. Действие карведилола на клиническое состояние
больных хронической сердечной недостаточностью изучалось также
в нескольких плацебо-контролируемых многоцентровых исследованиях
(MOCHA, PRECISE, ANZ и др.). Карведилол является современным b-адреноблокатором III поколения, обладающим наряду с b1-
и b2-блокирующими свойствами, дополнительным антиоксидантным,
антипролиферативным и вазодилатирующим действием. В эксперименте
на животных карведилол ограничивает зону некроза и ишемии после
окклюзии коронарных артерий, уменьшает частоту ишемических аритмий,
оказывает нейропротективное действие, снижает сердечно-сосудистую
смертность [16-18]. В исследованиях PRESISE [19], ANZ [20] и MOCHA
[21] также была продемонстрирована способность карведилола достоверно
уменьшать риск смерти больных с ХНК. Во всех случаях карведилол
достоверно повышал ФВ ЛЖ и ударный индекс. Механизм повышения
ФВ ЛЖ на фоне лечения карведилолом объясняется уменьшением КСО,
снижением постнагрузки и миокардиального стресса [22]. Однако
действие карведилола не ограничивается только свойствами b-адреноблокатора, оно включает, как уже отмечалось, антиоксидантное
и антипролиферативное воздействие на миокард.
В отличие от всех
предыдущих исследований в нашей работе оценивалась эффективность
терапии карведилолом не на фоне приема ингибитора АПФ, а в сравнении
с ним. Положительная динамика ФК НК, параметров общей и региональной
сократимости левого желудочка, а также перфузии миокарда на фоне
приема эналаприла и карведилола была более выраженной в группе
больных ИБС с наличием жизнеспособного миокарда в зонах диссинергии
и у больных ДКМП с относительно высоким резервом сократимости
миокарда. Это подтверждает гипотезу о благоприятном воздействии
ингибиторов АПФ и b-адреноблокаторов на подверженный
риску "спящий" миокард. Наиболее показательные изменения изучаемых
параметров были обнаружены в группе обследованных больных, получавших
комбинированную терапию эналаприлом и бисопрололом, что, безусловно,
объясняется потенцированием действия ингибитора АПФ b-адреноблокатором. При этом наилучшие результаты комбинированной
терапии были получены в группе больных ДКМП. По данным исследования
CIBIS [23], снижение показателя смертности на 20% и уменьшение
числа госпитализаций в связи с обострением ХСН на 28% под влиянием
бисопролола было отмечено также у больных с неишемической этиологией
ХСН (ДКМП). Проводя сравнительную оценку эффективности общей медикаментозной
терапии у больных ИБС и ДКМП, мы не обнаружили существенного различия
в изменении изучаемых параметров в целом между ними. Однако при
разделении больных ИБС и ДКМП на подгруппы в зависимости от наличия
или отсутствия признаков жизнеспособности диссинергичного миокарда
и от величины резерва общей сократимости левого желудочка по данным
ДСЭ выявлено, что медикаментозная терапия наиболее эффективна
у больных ДКМП с высоким резервом глобальной сократимости на добутамине
и неэффективна в группе больных ДКМП с низким резервом сократимости
на добутамине.
В заключение мы
хотим предложить алгоритм обследования и возможного восстановления
сократимости жизнеспособного миокарда у больных ИБС и ДКМП с ХНК.
При выявлении жизнеспособного
миокарда у больных ИБС приоритетным методом лечения является хирургическая
или эндоваскулярная реваскуляризация миокарда [2, 3]. Медикаментозная
терапия может быть предложена в качестве поддерживающей жизнеспособность
гибернирующего миокарда до решения вопроса о дальнейшем восстановлении
нарушенного кровотока. Больным ИБС с отсутствием признаков жизнеспособности
диссинергичного миокарда, как и больным ДКМП с относительно высоким
резервом сократимости по данным ДСЭ, показано медикаментозное
лечение (ингибиторами АПФ, b-адреноблокаторами и т.д.). Пациенты же с ДКМП, имеющие
низкий резерв глобальной сократимости на добутамине, могут рассматриваться
как потенциальные кандидаты на возможную трансплантацию сердца.
Литература
1. Беленков Ю.Н., Саидова М.А. Оценка жизнеспособности миокарда: клинические
аспекты, методы исследования. Кардиология 1999; 1: 6-13.
2. Rahimtoola S.H. A perspective on the three large multicenter
randomized clinical trials of coronary bypass surgery for chronic
stage angina. Circulation 1985; 72: V123–V135.
3. Pigott J.D., Kouchoukos N.T., Oberman A. et al. Late results
of surgical and medical theraoy for patients with coronary artery
disease and depressed left ventricular function. J Am Coll Cardiol
1985; 5: 10436-1045.
4. Di Carli M., Davidson M., Little R. et al. Value of metabolic
imaging with positron emission to mography for evaluating prognosis
in patients with coronary artery disease and left ventricular
dysfunction. Am J Cardiol 1994; 73: 527–33.
5. Tillisch J., Brunken R., Marschall R. et al. Reversibility
of cardiac wall-motion abnormalities predicted by positron tomography.
N Engl J Med 1986; 314: 884-8.
6. Furberg C.D., Hawkins C.M., Lichstein E. and BHAT Study Group.
Effect of propranolol in postinfarction patients with mechanical
or electrical complications. Circulation 1984; 69: 761.
7. Rahimtoola S.H. The hibernating myocardium. Am Heart J 1989;
117: 211-21.
8. Fishman W.H., Furberg C.D., Fridelwald W.T. The use of beta-adrenergic
blocking drugs in patients with myocardial infarction. Curr Probl
Cardiol 1984; 9.
9. Наумов В.Г. Клинико-инструментальная
характеристика, дифференциальная диагностика и прогноз больных
дилатационной кардиомиопатией (Результаты 15-летнего проспективного
наблюдения): Автореф. дисс. …докт. мед. наук. М.; 1995.
10. Factor S.M., Sonnenblick E.H. Hypothesis: is congestive cardiomyopathy
caused by a hyperactive myocardial microcirculation (microvascular
spasm)? Amer J Cardiol 1982; 50: 1148–52.
11. Ismer J.M., Virmani R., Itscoits J.B. Left and right ventricular
myocardial infarction in idiopathic dilated cardiomyopathy. Amer
Heart J 1980; 99 (2): 235–42.
12. Sonnenblick E.H., Fein F., Capasso J.M. Microvascular spasm
as a cause of cardiomyopathies and the calcium-blocking agent
verapamil as potential primary therapy. Amer J Cardiol 1985; 55:
179B-184B.
13. Afridi I., Kleiman N.S., Rainzer A.E., Zoghbi W.A. Dobutamine
echocardiography in myocardial hibernation. Circulation 1995;
91: 663-70.
14. Bonow R.O., Dilsizian V., Cuocola A., Bacharach S.L. Identification
of myocardium in patients with chronic coronary artery and left
ventricular dysfunction. Comparison of thallium scintigraphy with
reinjection and PET imaging with 18-F-Fluorodeoxyglucose. Circulation
1991; 83: 26–37.
15. Мареев В.Ю. Изменение
стратегии лечения хронической сердечной недостаточности. Время
b-адреноблокаторов. Кардиология 1998; 12: 4–11.
16. Hashimoto H., Tanako M., Kanola A., Akashi A. Analisis of
the mechanism underlying the vasodilatator action of carvedilol
in pithed spontaneously hypertensive rats. Drugs 1988.
17. Brill A., Slivjac M., DiMartino M.J. et al. Cardioprotective
effects of carvedilol, a novel beta adrenoceptor antagonist with
vasodilating properties, in anesthetized minipigs: Comparison
with propranolol. Cardiovasc Res 1992; 26: 518-25.
18. Lahiri A., Basu S., Senior R. et al. Reduction of adverse
cardiac events by carvedilol after acute myocardial infarction.
Eur Heart J 1995; 16; 36: 306.
19. Packer M., Colucci W.S., Sackner-Bernstein J.D. et al. for
the PRECISE Study Group. Double-blind, placebo-controlled study
of the effects of carvedilol in patients with moderate to severe
heart failure: the PRECISE trial. Circulation 1996; 94: 2793-9.
20. Australia – New Zealand Heart Failure Research Collaborative
Group. Effects of carvedilol, a vasodilator-b-blocker, in patients with congestive heart failure due to ischemic heart
disease. Circulation 1995; 92: 212–8.
21. Bristow M.R., Gilbert E.M., Abraham W.T. et al. For the MOCHA
Investigators. Carvedilol produces dose-related improvements in
left ventricular function and survival in subjects with chronic
heart failure. Circulation 1996; 94: 2807–16.
22. Chatterjee K. Heart failure therapy in evolution. Circulation
1996; 94; 11: 2689–93.
23. CIBIS Investigators and Committees. A randomized trial of
b - blockade in heart failure: The Cardiac Insufficiency Bisoprolol
Study (CIBIS). Circulation 1994; 90: 1765–73.
