Биопленка: новый взгляд на бляшку
Биопленка: новый взгляд на бляшку
URL
В течение последних 120 лет исследователи-стоматологи пытались понять микробную природу болезней ротовой полости. Их взгляды на зубную бляшку и составляющие ее микроорганизмы менялись от гипотез о специфичности бляшки к предположениям об ее неспецифичности и
 снова
возвращались к теории о наличии специфических пародонтальных патогенов
в бляшке. Изменения во взглядах на бляшку и образующие ее микроорганизмы
влияют на стратегию профилактики заболеваний пародонта и контроля
за ними. В последние годы некоторые исследователи-стоматологи стали
рассматривать бляшку как биопленку. Такое изменение взгляда на бляшку
является важной основой будущих усилий по профилактике и лечению.
Данная статья освещает различные, менявшиеся с годами представления
специалистов-стоматологов о бляшке, выдвигая на первый план современный
взгляд на бляшку как на биопленку, и описывает разновидности терапии
болезней пародонта.
снова
возвращались к теории о наличии специфических пародонтальных патогенов
в бляшке. Изменения во взглядах на бляшку и образующие ее микроорганизмы
влияют на стратегию профилактики заболеваний пародонта и контроля
за ними. В последние годы некоторые исследователи-стоматологи стали
рассматривать бляшку как биопленку. Такое изменение взгляда на бляшку
является важной основой будущих усилий по профилактике и лечению.
Данная статья освещает различные, менявшиеся с годами представления
специалистов-стоматологов о бляшке, выдвигая на первый план современный
взгляд на бляшку как на биопленку, и описывает разновидности терапии
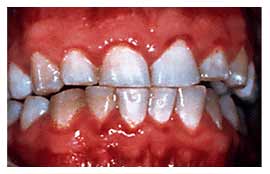
болезней пародонта.Несмотря на усилия специалистов-стоматологов, инфекции ротовой полости по-прежнему широко распространены. Среднестатистический взрослый американец имеет от 10 до 17 разрушенных, удаленных или запломбированных постоянных зубов. Большинство жителей США болели гингивитом, меньшая часть страдает умеренно выраженными или тяжелыми формами заболеваний пародонта (рис. 1).
 Общепризнанно,
что микрофлора ротовой полости является многообразной и наличие
специфических бактерий во внутриротовой бляшке рассматривается как
необходимая, но недостаточная причина возникновения заболевания.
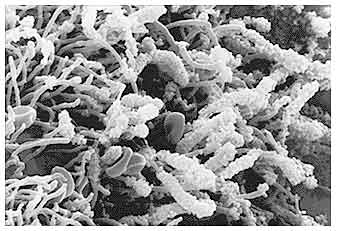
До конца не ясно, как именно микроорганизмы бляшки (рис. 2) вызывают
заболевания ротовой полости.
Общепризнанно,
что микрофлора ротовой полости является многообразной и наличие
специфических бактерий во внутриротовой бляшке рассматривается как
необходимая, но недостаточная причина возникновения заболевания.
До конца не ясно, как именно микроорганизмы бляшки (рис. 2) вызывают
заболевания ротовой полости. Компоненты зубной бляшки и входящие в нее микроорганизмы изучаются с помощью аналитического оборудования, и полученные результаты влияют на стратегию контроля и профилактику заболеваний зубов. За последние два десятилетия современные научные методы изменили взгляд на зубную бляшку, и сейчас многие ученые-стоматологи рассматривают ее как биопленку.
Биопленка
Биопленка — это хорошо организованное, взаимодействующее сообщество микроорганизмов. Классическим примером биопленки может служить тонкое наслоение на скалах, находящихся посреди течения. Подобные бляшки образуются и в ротовой полости. В природе биопленки
 распространены
повсеместно. Они формируются в условиях текучести. Установлено,
что свыше 95% существующих в природе бактерий находятся в биопленках.
Иногда биопленки могут быть полезными, например, их применяют для
обеззараживания отработанных и сточных вод.
распространены
повсеместно. Они формируются в условиях текучести. Установлено,
что свыше 95% существующих в природе бактерий находятся в биопленках.
Иногда биопленки могут быть полезными, например, их применяют для
обеззараживания отработанных и сточных вод. Тонкое наслоение, формирующееся на зубах,— пример, знакомый большинству специалистов-стоматологов. Биопленки выстилают нефтепроводы, аквариумы, постоянные катетеры, внутренние имплантаты, контактные линзы и протезы (рис. 3).
Биопленки могут оказаться смертоносными. Болезнь легионеров, унесшая жизни 29 человек в Филадельфии в 1976 г., в конечном счете оказалась связанной с бактериями биопленки в системе кондиционирования воздуха. Миллионы долларов ежегодно расходуются на работы по контролю за этими биопленками.
Изменение взглядов на бляшку
Национальный институт стоматологических и черепнолицевых исследований недавно проводил международную конференцию по микробной экологии. Эта встреча сосредоточила внимание на новом взгляде на бляшку как на биопленку. Конференция подчеркнула важность изменения мнения о зубной бляшке и ее роли в развитии заболеваний ротовой полости. Такая смена взглядов стоматологов на бляшки происходит не впервые, за последние 120 лет эти воззрения претерпели различные изменения.
Период с 1880 по 1930 получил название золотого века микробиологии. За это время были дифференцированы возбудители многих важнейших системных инфекций. Исследователи также искали единственную специфическую причину заболеваний ротовой полости. Предполагая, что бляшка содержит специфический микроорганизм, вызывающий заболевания пародонта, ученые-стоматологи исследовали бляшки в поисках этого возбудителя. Используя доступные в то время методики (микроскопию влажных и окрашенных мазков), ученые идентифицировали различные группы потенциальных возбудителей заболеваний пародонта. У пациентов с заболеваниями пародонта были выделены амебы, спирохеты, веретенообразные бактерии и стрептококки, считавшиеся, таким образом, потенциальными возбудителями. Лечение болезней пародонта в то время различалось в зависимости от предполагаемых причин заболевания и включало красители, систематическое применение мышьяксодержащих антимикробных препаратов, внутримышечные инъекции препаратов ртути, а также вакцины.
1930-е годы возвестили о новом взгляде на роль бляшки и ее микроорганизмов в этиологии заболеваний пародонта. Ученые-стоматологи предположили, что заболевания пародонта связаны с неким конституциональным дефектом индивидуума. Считалось, что механические раздражители, такие как камни и нависающие края реставраций, также играют важную роль в патогенезе заболеваний пародонта.
На смену уверенности в наличии единственного микробного возбудителя заболеваний пародонта пришли теории неспецифичности бляшек. Гипотеза о неспецифичности бляшки предполагала, что в деструкции пародонта играет роль скорее вся бактериальная флора бляшки, чем специфические бактерии одного вида. Вся бляшка рассматривалась как патогенная. Кроме того, наличие бляшки означает отягощенное течение заболевания. Контроль за бляшками считался необходимым для ограничения производства веществ, раздражающих десны и приводящих к воспалению и разрушению пародонта. Идентификация специфических микроорганизмов была не важна, важен был строгий контроль за бляшками, и это стало центральным моментом в терапии болезней пародонта.
1960-е отмечены возвращением к гипотезе о специфичности бляшки. Исследователи успешно показали возможность передачи заболеваний пародонта между хомяками. Электронная микроскопия подтвердила наличие спирохет в соединительной и эпителиальной тканях пациентов с острым язвенно-некротическим гингивитом в противоположность здоровым лицам контрольной группы. Допустив, что вызванные разными видами микробов бляшки отличаются друг от друга, ученые снова вернулись к поиску специфического микробного пародонтального возбудителя и лечения, нацеленного на причинный фактор.
Новейшие методы микробиологических исследований, такие как микроскопия в затемненном поле, трансмиссионная электронная микроскопия, сканирующая электронная микроскопия, исследования ДНК и иммунологический анализ помогли в исследованиях.
 С
тех пор ученые продолжают поиски специфического этиологического
агента с переменным успехом. Haffajee и Socransky подробно описали
причины, затрудняющие точное указание специфических патологических
агентов. Некоторые из этих трудностей относятся к процессу отбора
микробиологических проб и их культивированию. Эти проблемы включают:
получение образца из пародонтального кармана, трудности культивирования
некоторых микроорганизмов и большое количество пародонтальных патогенных
микроорганизмов, которые могут быть обнаружены в пародонтальном
кармане и затем выращены. Забор проб еще более усложняется тем фактом,
что в пародонтальном кармане содержатся не только патогенные, но
и сапрофитные виды микрофлоры. Другая группа проблем в точном определении
возбудителей болезней пародонта относится к самой природе этих заболеваний.
Во-первых, патология пародонтита — не одно, а группа различных заболеваний.
Во-вторых, эти заболевания имеют периоды активности и «затишья»,
и активность заболевания варьирует в пределах организма. И, наконец,
трудность в идентификации специфических возбудителей пародонтита
связана с колебаниями индивидуальной реакции организма хозяина.
С
тех пор ученые продолжают поиски специфического этиологического
агента с переменным успехом. Haffajee и Socransky подробно описали
причины, затрудняющие точное указание специфических патологических
агентов. Некоторые из этих трудностей относятся к процессу отбора
микробиологических проб и их культивированию. Эти проблемы включают:
получение образца из пародонтального кармана, трудности культивирования
некоторых микроорганизмов и большое количество пародонтальных патогенных
микроорганизмов, которые могут быть обнаружены в пародонтальном
кармане и затем выращены. Забор проб еще более усложняется тем фактом,
что в пародонтальном кармане содержатся не только патогенные, но
и сапрофитные виды микрофлоры. Другая группа проблем в точном определении
возбудителей болезней пародонта относится к самой природе этих заболеваний.
Во-первых, патология пародонтита — не одно, а группа различных заболеваний.
Во-вторых, эти заболевания имеют периоды активности и «затишья»,
и активность заболевания варьирует в пределах организма. И, наконец,
трудность в идентификации специфических возбудителей пародонтита
связана с колебаниями индивидуальной реакции организма хозяина.Несмотря на эти трудности, нынешние исследователи по-прежнему согласны с тем, что заболевания пародонта являются инфекциями, вызванными специфическими патогенными микроорганизмами. Недавно было обращено внимание на Bacteroides forsythus, а также на P. gingivalis и A. actinomycetemcomitans как на первичных важнейших возбудителей большинства инфекций пародонта, явно связанных с другой подгруппой микроорганизмов (C. rectus, E. nodatum, F. nucleatum, P. intermedia/nigrescens, P. micros, S. intermedium и T. denticola) как с возможными болезнетворными микробами. Исследователи заняты разработкой и совершенствованием диагностических тестов для обнаружения возбудителя пародонтита и его лечения. Были предложены антибиотики общего действия, такие как амоксициллин, метронидазол, тетрациклин, доксициклин и аугментин. Было также представлено местное применение антимикробных средств: тетрациклиновых волокон, гелей метронидазола и миноциклина, тонких пластинок хлоргексидина и полимера доксициклина. Хотя эти подходы увеличили наши возможности справиться с заболеваниями пародонта, они все же не смогли обеспечить стабильный успех. Рассмотрение бляшки как биопленки обещает помочь в попытках эффективно лечить пародонтит.
Бляшка как биопленка
Раньше изучались бактерии, выращенные в колониях на чашках Петри в лабораториях. Более усложненная микроскопия, такая как однофокусный сканирующий лазер, позволила исследовать биопленки в их естественных состояниях. Микроорганизмы в биопленке ведут себя не так, как бактерии в культурной среде.
Основные свойства биопленки:
- Взаимодействующая общность разных типов микроорганизмов
- Микроорганизмы собраны в микроколонии
- Микроколонии окружены защитным матриксом
- Внутри микроколоний — различная среда
- Микроорганизмы имеют примитивную систему связи
- Микроорганизмы в биопленке устойчивы к антибиотикам, антимикробным средствам и реакции организма хозяина
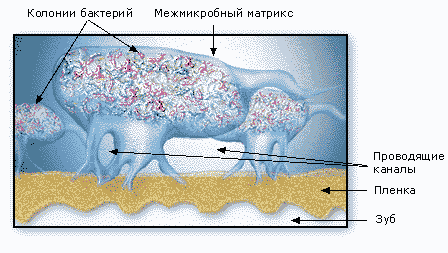
Наблюдаемые в микроскоп бактерии в биопленке распределены неравномерно. Они сгруппированы в микроколонии, окруженные обволакивающим межмикробным матриксом (рис. 5).
 Матрикс
пронизан каналами, по которым циркулируют питательные вещества,
продукты жизнедеятельности, ферменты, метаболиты и кислород. Эти
микроколонии имеют свои микросреды, отличающиеся уровнями рН, усваиваемостью
питательных веществ, концентрациями кислорода (рис. 6). Бактерии
в биопленке общаются между собой посредством химических раздражений
(сигналов) (рис. 7). Эти химические раздражители вызывают выработку
бактериями потенциально вредных белков и ферментов.
Матрикс
пронизан каналами, по которым циркулируют питательные вещества,
продукты жизнедеятельности, ферменты, метаболиты и кислород. Эти
микроколонии имеют свои микросреды, отличающиеся уровнями рН, усваиваемостью
питательных веществ, концентрациями кислорода (рис. 6). Бактерии
в биопленке общаются между собой посредством химических раздражений
(сигналов) (рис. 7). Эти химические раздражители вызывают выработку
бактериями потенциально вредных белков и ферментов.Наши предшествующие попытки предвидеть и контролировать заболевания пародонта были основаны на свойствах бактерий, выращенных в лабораторных условиях. С пониманием сути биопленки было показано,
 что
существуют большие различия в поведении бактерий в лабораторной
культуре и в их естественных экосистемах. К примеру, бактерия в
биопленке вырабатывает такие вещества, которые она не продуцирует,
будучи в культуре. Кроме того, матрикс, окружающий микроколонии,
служит защитным барьером. Это помогает понять, почему антимикробные
средства как общего действия, так и применяемые местно, не всегда
дают успешные результаты, даже тогда, когда они нацелены на конкретный
вид микроорганизмов. Это также помогает объяснить, почему механическое
удаление бляшек и личная гигиена ротовой полости продолжают оставаться
неотъемлемой составной частью лечения заболеваний пародонта. Биопленки
могут быть удалены механическими средствами, однако они немедленно
начинают восстанавливаться, поэтому поиск путей борьбы с биопленками
продолжается.
что
существуют большие различия в поведении бактерий в лабораторной
культуре и в их естественных экосистемах. К примеру, бактерия в
биопленке вырабатывает такие вещества, которые она не продуцирует,
будучи в культуре. Кроме того, матрикс, окружающий микроколонии,
служит защитным барьером. Это помогает понять, почему антимикробные
средства как общего действия, так и применяемые местно, не всегда
дают успешные результаты, даже тогда, когда они нацелены на конкретный
вид микроорганизмов. Это также помогает объяснить, почему механическое
удаление бляшек и личная гигиена ротовой полости продолжают оставаться
неотъемлемой составной частью лечения заболеваний пародонта. Биопленки
могут быть удалены механическими средствами, однако они немедленно
начинают восстанавливаться, поэтому поиск путей борьбы с биопленками
продолжается.Новые рубежи
Промышленные исследователи внедряют новые технологии борьбы с биопленками. Один из подходов предполагает вмешательство в обмен сигналами между бактериями таким образом, чтобы они не могли общаться между собой. Другой путь — подражание природной защите, выработанной обитателям океана, например, китами и дельфинами, не накапливающими бактериальные биопленки. Исследователи-стоматологи также продолжают следовать по пути новых стратегий для препятствия развития биопленок в ротовой полости.
Возможные стратегические направления для предотвращения развития биопленок в ротовой полости
Регуляция питания
- примесь питательных веществ, образующих основания (аргинин)
- уменьшение циркуляции в зубодесневом желобке благодаря противовоспалительным средствам
- ингибирование ключевых микробных ферментов
Регулирование рН биопленки
- сахарозаменители
- антимикробные средства
- фтористые соединения
- стимуляция выработки оснований
Регулирование окислительно-восстановительного потенциала
- вещества-восстановители
- вещества-окислители
Изменение концентрации кислорода, рН, усваиваемости питательных веществ в бляшке показало возможность моделирования микрофлоры биопленки и может оказаться полезным. Например, пародонтальным патогенным микроорганизмам для роста необходим низкий окислительно-восстановительный потенциал. Показано, что добавление окислителя, такого как метиленовый синий, в пародонтальные карманы подавляет рост P. gingivalis. Поскольку увеличение циркуляции в зубодесневом желобке улучшает обеспечение питанием поддесневой биопленки, регулирование этой циркуляции может в будущем использоваться для контроля за поддесневой биопленкой. Использование противовоспалительных средств может не только помочь подавить разрушительные тенденции в организме хозяина, но и уменьшить поступление питательных веществ в биопленку в процессе циркуляции в зубодесневом желобке.
Литература
1. Slavkin HC. Biofilms, microbial ecology and Antoni Van Leeuwenhoek. J Am Dent Assoc 1997;128: 492-495.
2. Douglass C, Fox C. Cross-sectional studies in periodontal disease: Current status and implications for dental practice. Adv Dent Res 1993;7: 25-31.
3. DuPont GA. Understanding dental plaque; biofilm dynamics. J Vet Dent 1997;14: 91-94.
4. Marsh PD, Bradshaw DJ. Dental plaque as a biofilm. J Industrial Microbiology 1995;15: 169-175.
5. Costerton JW, Lewandowski Z, DeBeer D, et al. Biofilms, the customized microniche. J Bacteriology 1994;176: 2137-2142.
6. Shearer BJ. Biofilm and the dental office. J Am Dent Assoc 1996;127: 181-189.
7. Meyer KF 1917. The present status of dental bacteriology. J Am Dent Assoc 1917;4: 966-996.
8. Haffajee AD, Socransky SS. Evidence of bacterial etiology: a historical perspective. Periodontology 2000 1994;5: 7-25.
9. Willmann DE, Chaves ES. The role of dental plaque in the etiology and progress of inflammatory periodontal disease. In Harris NO, Garcia-Godoy F eds. Primary preventive dentistry. Stamford, CO: Appleton & Lange; 1999:63-76.
10. Kimball GD. The relationship of materia alba and dental plaque to periodontal disease. J Periodontol 1952;23: 16-169.
11. Keyes PH, Jordan HV. Periodontal lesions in the Syrian hamster. III. Findings related to an infectious and transmissible component. Arch Oral Biol 1964;9: 377-400.
12. Listgarten MA. Electron microscopic observations of the bacterial flora of acute necrotizing ulcerative gingivitis. J Periodontol 1965;36: 328-339.
13. Papapanou PN, Engebretson SP, Lamster IB. Current and future approaches for diagnosis of periodontal diseases. NY State Dent J 1999;32-39.
14. Haffajee AD, Socransky SS. Microbial etiological agents of destructive periodontal diseases. Periodontol 2000 1994;5: 78-111.
15. Page RC, Offenbacher S, Schroeder HE, et al. Advances in the pathogenesis of periodontitis: summary of developments, clinical implications and future directions. Periodontology 2000 1997;14: 216-248.
16. Consensus report on periodontal diseases: pathogenesis and microbial factors. Ann Periodontol 1996;1: 12-32.
17. Greenstein G, Polson A. The role of local drug delivery in the management of periodontal diseases: A comprehensive review. J Periodontol 1998;69: 507–520.
18. Greenstein G. Periodontal response to mechanical non-surgical therapy: a review. J Periodontol 1992;63: 118-130.
19. Marsh PD, Bradshaw DJ. Physiological approaches to the control of oral biofilms. Adv Dent Res 1997;11: 176-185.
20. Wilson M, Gibson M, Strahan D, et al. A preliminary evaluation of the use of a redox agents in the treatment of chronic periodontitis. J Periodont Res 1992;27: 522-527.
21. Adapted from Marsh and Bradshaw. Physiological approaches to the control of oral biofilms. Adv Dent Res 1997;11: 176-185.
