Высокоэффективная антиретровирусная терапия
Высокоэффективная антиретровирусная терапия
В.Б. Белобородов
Кафедра инфекционных болезней Российской медицинской академии последипломного образования, Москва
URL
Введение
Появление большого количества новых антиретровирусных
препаратов и нарастающий поток научной информации по результатам
их применения представляют собой определенную проблему в плане
выбора оптимальной антиретровирусной терапии (АРВТ) лиц, инфицированных
вирусом иммунодефицита человека (ВИЧ). Начиная с 1996 г. в данных,
представленных Центром по
контролю за заболеваниями (CDC, США), отмечено снижение летальности
пациентов со СПИДом на 23%, а в 1997 г. - на 44%. Число пациентов
со СПИДом, нуждающихся в стационарном лечении, снизилось на 45-55%.
Поэтому 1996 г. считается важной вехой изменения стратегии борьбы
с инфекцией ВИЧ. Впервые применение ингибиторов протеаз (ИП) в
комплексе АРВТ привело не только к задержке развития заболевания,
но и реально снизило летальность, и создало перспективу неограниченной
продолжительности жизни пациентов, инфицированных ВИЧ.
С конца 80-х годов до настоящего времени группой
экспертов США разработаны и постоянно совершенствуются рекомендации
по лечению взрослых и подростков, инфицированных ВИЧ [1-4]. Эти
рекомендации представляют собой систему диагностики и мониторинга
пациентов, инфицированных ВИЧ. В них впервые в 1996 г. была обоснована
необходимость измерения плазматической концентрации РНК ВИЧ для
определения показаний к началу и оценки эффективности терапии.
Активная разработка и клиническое изучение новых антиретровирусных
препаратов позволили сформулировать новые подходы к лечению. Изменилась
и возможность доступа к новейшей научной информации и практическим
рекомендациям. В настоящее время эти рекомендации представлены
в сети Интернет, доступны для использования в виде справочного
материала, ежемесячно изменяются и дополняются (HIV/AIDS Treatment
Information Service, http://www.Hivatis.Org). В них подробно представлены
основные принципы подбора препаратов и тактики ведения больных.
Подобно лечению всех хронических заболеваний, АРВТ представляет
собой комплекс проблем, которые связаны с возможностью побочных
эффектов, комплаентностью, риском развития резистентности при
отступлении от режима приема препаратов или применении неоптимальной
комбинации. Обучение пациентов и вовлечение их в обсуждение терапевтических
проблем важны для всех пациентов-хроников, но особенно критическими
они являются для инфицированных ВИЧ.
Таблица 1. Основные антиретровирусные препараты
| Группа препаратов | Генерическое название | Торговое название |
| ИП | Indinavir Nelfinavir Sanquinavir (мягкие капсулы) Sanquinavir (жесткие капсулы) Ritonavir |
Crixivan Virasept Fortavase Invirase Norvir |
| НИОТ | AZT (zidovudin,
azidothymidine) ddI (didanozine, dideoxyinosine) ddC (zalcitabine, dideoxycytidine) d4T (stavudine, dideoxythymidine) 3TC (lamivudine, thiacydine) AZT + 3TC |
Retrovir Videx Hivid Zerit Epivir Combivir |
| ННИОТ | Nevirapine
Delavidine Efavirenz, DMP-266 |
Viramun
Rescriptor Sustiva, stocrin |
Таблица 2. Прогностическое значение показателя вирусной нагрузки в отношении развития СПИДа и смерти пациентов с ВИЧ
| Вирусная нагрузкаВИЧ РНК (копий/мл) | Показатель развития СПИДа в течение6 лет (%) | Показатель летальности инфицированных ВИЧ в течение 6 лет (%) |
| > 30 000 | 80 | 69,5 |
| 10 001 - 30 000 | 55,2 | 34,9 |
| 3 000 - 10 000 | 31,7 | 18,1 |
| 501 - 3 000 | 16,6 | 6,3 |
| < 500 | 5,4 | 0,9 |
Таблица 3. Перекрестная резистентность штаммов ВИЧ-1 в отношении ингибиторов протеаз
| Штаммы (n = количество) с более чем 10-кратной резистентностью к препаратам |
% перекрестной резистентности ( > 4Х) к следующим препаратам: |
|||
| Криксиван | саквинавир | ритонавир | нельфинавир | |
| Криксиван (n = 512) |
- |
84 |
95 |
89 |
| Саквинавир (n = 572) |
88 |
- |
95 |
89 |
| Ритонавир (n = 625) |
93 |
79 |
- |
88 |
| Нельфинавир (n = 698) |
84 |
79 |
87 |
- |
Эти рекомендации
касаются всех пациентов с ВИЧ: и вновь заболевших, и пациентов
с клиническими признаками инфекции. Лечение показано пациентам
с количеством CD4+ T клеток/мм3
менее 300 или уровнем РНК ВИЧ в плазме, превышающим 10 000 копий/мл
(bDNA ) или 20 000 копий/мл (RT-PCR). В основе лечения пациентов
без клинических проявлений должны лежать такие факторы, как желание
начать терапию и точно следовать режиму приема препаратов. Прогноз
вероятности развития осложнений ВИЧ-инфекции должен быть основан
на величине плазматической концентрации РНК ВИЧ и количестве CD4+
клеток.
Выбор АРВТ должен преследовать основную цель - максимальное длительное подавление вируса. Результаты клинических испытаний указывают, что в настоящее время это может быть достигнуто с помощью ИП или ненуклеозидного ингибитора обратной транскриптазы (ПНИОТ-ифаверенца) в комбинации с двумя нуклеозидными аналогами обратной транскриптазы (НИОТ). Другим сочетанием является комбинация двух ИП (сангвинавира и ритонавира) с одним или двумя НИОТ. Другие доступные режимы могут быть использованы только по определенным показаниям и рассматриваются как недостаточные для максимального подавления репликации вирусов. Оценка результатов терапии должна проводиться прежде всего по снижению уровня плазматической РНК ВИЧ. Этот уровень должен снижаться на один десятичный логарифм (в 10 раз) в течение первых 8 нед и быть ниже предела измерения метода (< 500 копий/ мл) через 4-6 мес после начала лечения. Неэффективность терапии (т.е. уровень РНК ВИЧ в плазме выше 500 копий/мл) через 4-6 мес может быть связан с нарушением приема, неадекватным подбором или низкой дозой антиретровирусных препаратов, устойчивостью вирусов и другими факторами, которые пока непонятны. При неэффективности терапии, связанной с развитием резистентности к определенной группе препаратов необходимо произвести их замену. Рекомендуется замена, по крайней мере, двух препаратов на препараты, к которым теоретически не может быть перекрестной резистентности. Идеально было бы произвести полную замену препаратов на те, к которым не может быть перекрестной резистентности и эффективность которых доказана клиническими испытаниями по снижению вирусной нагрузки. Рациональное изменение режима терапии может быть особенно затруднительным у пациентов, для которых оптимальный режим оказался неэффективным. Особенно сложно выбрать альтернативный режим АРВТ, эффективность которого уже доказана. Иногда эту проблему путают с привычкой приема определенных препаратов, токсичностью и резистентностью. В некоторых случаях рациональным является включение пациента в клиническое испытание новых препаратов или новых схем использования известных препаратов.
Современные антиретровирусные препараты
Учитывая важность оценки роли группы препаратов
ИП в комплексной высокоэффективной АРТВ, необходимо обратиться
к современному опыту применения этих препаратов. В табл. 1 представлены
основные группы современных препаратов для проведения АРВТ. Необходимо
отметить, что различные группы препаратов подавляют определенные
этапы репликации ВИЧ. Поэтому комбинация АРВТ должна включать
препараты разных групп.
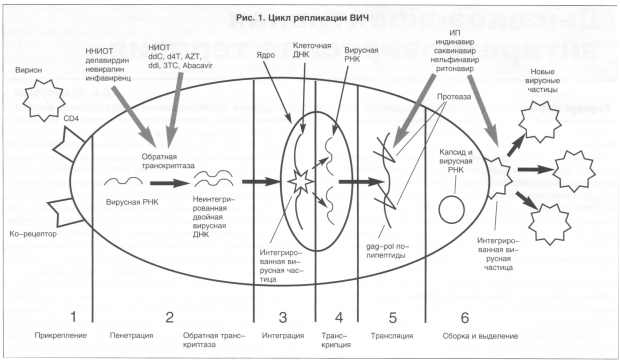
Для более точного определения механизма действия
препаратов обратимся к рис. 1. Цикл развития ВИЧ начинается с
прикрепления вирусной частицы к рецептору CD4 лимфоцита-хелпера.
Затем происходит пенетрация вирусной РНК в клетку, где с помощью
обратной транскриптазы происходит построение комплементарной цепочки,
в результате чего получается неинтегрированная двойная вирусная
ДНК. Затем происходит интеграция вирусной ДНК в клеточную ДНК.
При последующей активации клетки происходят транскрипция вирусной
РНК и трансляция. На этапе трансляции цепочка РНК подвергается
локальному протеолизу, в виде короткой цепочки РНК попадает в
вирион и выделяется в виде
новой вирусной частицы.
Действие нуклеозидных и ненуклеозидных ингибиторов
обратной транскиптазы подавляет процесс удвоения РНК после ее
проникновения в цитоплазму лимфоцита и, следовательно, все последующие
события. Действие ингибиторов направлено на протеазы, обеспечивающие
локальный протеолиз длинной цепи вирусной РНК. В результате этого
образуются вирионы, лишенные генетического материала и неспособные
к заражению новых клеток. Однако, как видно из механизма действия
препаратов всех групп, они не
способны элиминировать уже зараженные вирусом ВИЧ лимфоциты и
привести к освобождению от инфекции. Эти препараты способны эффективно
блокировать процесс дальнейшего воспроизведения вирусов и перевести
заболевания в латентную хроническую стадию.
Необходимо отметить, что количество вирусных
частиц представляет собой величину вирусной нагрузки, которую
мы тестируем с помощью RT-PCR в плазме крови пациентов. Этот показатель
указывает на количество частиц в определенном объеме крови. К
настоящему времени накопилось достаточное количество данных, позволяющее
определить прогноз инфекции ВИЧ у конкретного пациента. Так, на
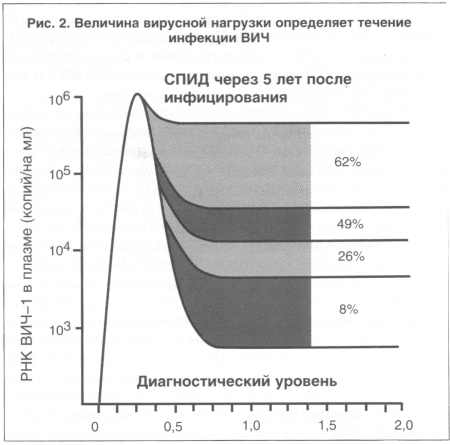
рис. 2 представлены данные, характеризующие вероятность развития
СПИДа в течение 5 лет после инфицирования ВИЧ [6]. Самую низкую
вероятность (порядка 8%) имели пациенты с относительно низкой
вирусной нагрузкой - 103 копий/мл. И, наоборот, при исходно высокой
вирусной нагрузке (более 105 копий/мл) у 62% пациентов с ВИЧ через
5 лет развился СПИД. Поэтому АРВТ, приводящая к снижению вирусной
нагрузки, является важнейшим компонентом профилактики развития
СПИДа. Аналогичные данные были получены и в другом проспективном
исследовании (табл. 2) [7]. Эти данные еще раз подтверждают важность
определения величины вирусной нагрузки как прогностического
фактора развития СПИДа и смерти пациентов,
инфицированных ВИЧ. Однако еще более важным оказалось внедрение
в клиническую практику в 1995 г. определения вирусной нагрузки
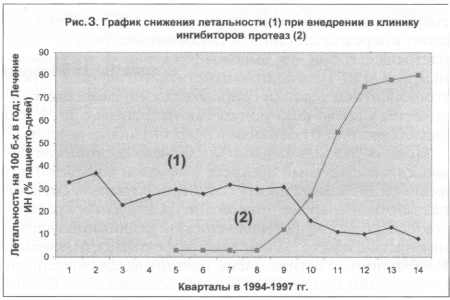
для мониторинга результатов лечения ИП. На рис. 3 показано снижение
числа летальных исходов в 3 раза на фоне внедрения ИП в клиническую
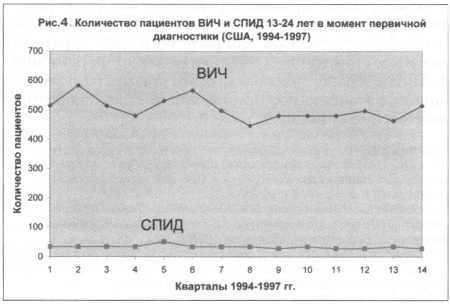
практику [8]. На рис. 4 графики показывают число пациентов с ВИЧ
и СПИДом на момент первичной диагностики инфекции. Эти данные
указывают на то, что снижение летальности, показанное на рис.
3, не связано с какими-либо изменениями в структуре инфекции ВИЧ,
а связано именно с внедрением в клиническую практику препаратов
группы ИП.
Важным аспектом эффективности АРВТ является
вероятность развития вирусов, устойчивых к данной группе препаратов.
Устойчивость вирусов к ИП ассоциируется с частотой замены аминокислот
при мутациях в гене, кодирующем протеазы. Отсутствие влияния единичных
точечных замен аминокислот на эффективность препарата является
его важным свойством. Имеются данные, свидетельствующие об отсутствии
устойчивости к индинавиру при замене одной или двух аминокислот.
При замене трех аминокислот резистентность возрастает в 2,5 раза,
четырех - в 4 раза и пяти - в 8 раз [9]. Эти данные свидетельствуют
о том, что единичные точечные мутации в гене, кодирующем протеазы,
не могут приводить к снижению эффективности данного препарата.
В то время как множественные мутации, приводящие к существенному
снижению эффективности препарата, являются достаточно редкими.
Имеются данные о перекрестной резистентности штаммов ВИЧ, полученных от больных, в отношении отдельных препаратов
ИП (табл. 3). Обнаружено, что клинические штаммы ВИЧ, обладающие
резистентностью к одному из ИП, могут иметь высокую вероятность
резистентности и к другим препаратам этой группы.
В реальной клинической практике применение ИП
также сопровождается определенными положительными тенденциями.
В одном из исследований, проведенных в Великобритании [10], приведены
данные о динамике показателей количества лимфоцитов-хелперов и
изменении тактики применения антиретровирусных пациентов в крупном
центре лечения пациентов, инфицированных ВИЧ. Особый интерес это
исследование имеет именно потому, что в нем приведены данные только
о тех пациентах, которые не участвовали в испытании новых препаратов,
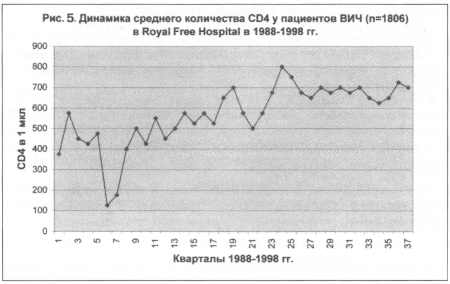
а получали рутинное лечение. На рис. 5 изображен график усредненного
показателя CD4 лимфоцитов у всех пациентов, находившихся на лечении
в больнице. Необходимо отметить стабилизацию этого показателя
около 300 CD4 лимфоцитов в микролитре, начиная с 1995 г. Авторы
откровенно признают, что применение методов количественного измерения
вирусной нагрузки они стали применять не очень давно - с 1997
г., поэтому динамика количества лимфоцитов-хелперов являлась долгое
время основным критерием оценки эффективности лечения пациентов.
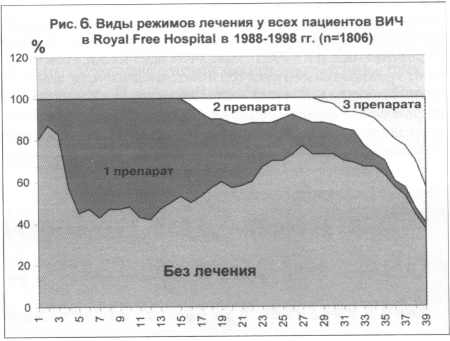
Изменения тактики АРВТ представлены на рис. 6 и 7. На рис. 6 показана
реальная тактика проведения АРВТ у пациентов, которые не были
включены в какие-либо клинические исследования. Так, в конце 80-х
годов подавляющее число пациентов не получало АРВТ. С внедрением
НИОТ в начале 90-х годов около 50% пациентов стали получать монотерапию
азидотимидином. Как видно из графика, к настоящему времени монотерапия
практически не применяется. С 1992 по 1998 г. 10-15% пациентов
получали комбинацию двух препаратов НИОТ. После внедрения в клиническую
практику ИП число пациентов, получающих трехкомпонентную терапию,
стало быстро увеличиваться, и к 1998 г. около 40% всех пациентов
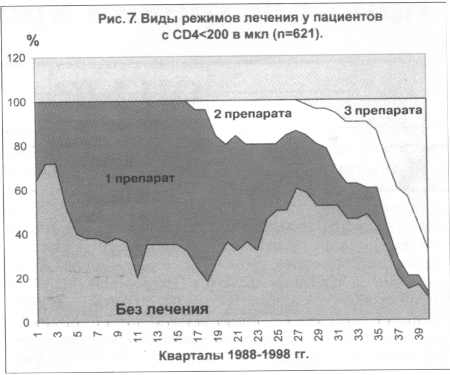
получали трехкомпонентную терапию. Аналогичная динамика представлена
и на рис. 7 у более тяжелых пациентов - с уровнем CD4 менее 200
в мкл. В этой группе трехкомпонентная терапия в 1998 г. применялась
уже более часто - у 60% пациентов. Результаты этого исследования
отражают современную тенденцию применения АРВТ, которая состоит
в переходе от одно- к двухкомпонентной АРВТ, а в настоящее время
- к высокоэффективной трехкомпонентной АРВТ. Необходимо отметить,
что переход к трехкомпонентной терапии сопровождался повышением
количества CD4 во всей популяции пациентов с ВИЧ, что свидетельствует
о повышении эффективности лечения.
Таким образом, в течение последнего десятилетия
появился значительный прогресс в лечении больных с инфекцией ВИЧ.
Этот прогресс в первую очередь связан с разработкой современных
антиретровирусных препаратов, способных эффективно снижать репликацию
вирусных частиц, и методов контроля эффективности лечения. Необходимо
отметить очень важный вклад, внесенный препаратами группы ИП.
Именно их внедрение в клиническую практику привело к реальному
контролю развития инфекции ВИЧ, снижению вирусной нагрузки, увеличению
количества CD4 лимфоцитов и даже обратному развитию симптомов
СПИДа. Очень важно, что комбинированная терапия, включающая эти
препараты, получила широкое клиническое применение и стала стандартом
лечения инфекции ВИЧ.
Литература:
1. CDC. 1993 Revised classification sistem for
HIV infection and explanded surveillance case definition for AIDS
among adolescents and adults. MMWR 1992; 411 (No. RR-17).
2. Centers for Disease Control and Prevention:
Clinical Update - Impact of HIV protease inhibitors
on the treatment of HIV infected tuberculosis patients with rifampine.
MMWR 1996; 45: 921-5.
3. Centers for Disease Control and Prevention:
Update: Provision public health service recommendations for chemoprophylaxis
after occupational exposure to HIV. MMWR 1996; 45: 468-80.
4. Guidelines for the Use of Antiretroviral
Agents in HIV-infected Adults and Adolescents. US Health &
Human services, May 1999.
5. HIV/AIDS Handbook. Total Learning Concepts,
Inc. 1995.
6. Ho DD. Viral count in HIV infection. Science
1995; 272: 1124-5.
7. Mellors J, Munoz A, Giorgi J et al. Plasma
viral load and CD4+ lynphocytes as prognostic markers of HIV-1
infection. Ann Intern Med 1997; 126: 946-54.
8. Perelson A, Essunger Y, Cao Y et al. : Decay
characteristics of HIV-1 infected compartments during combination
therapy. Nature 1997; 387: 188-91.
9. Condra JH. Genetic correlates of in vivo
viral resistence to indinavir, a human immunodeficiency virus
type 1 protease inhibitor. J Virol 1996; 70 (12): 8270-6.
10. Mocroft A, Sabin CA, Youle M et al. Changing
treatment patterns among patients with HIV: Royal Free Hospital
1987-97. HIV Medicine 1999; 1: 32-9.
