Акушерство и гинекология - Состояние овуляторной функции и результативность терапии тиреоидными гормонами в высоких дозах диффузной мастопатии у пациенток в состоянии эутиреоза
Состояние овуляторной функции и результативность терапии тиреоидными гормонами в высоких дозах диффузной мастопатии у пациенток в состоянии эутиреоза
Горюшина О.Г., Красильникова Е.И.
C-Петербург, "Маммологический центр" поликлиники №32
URL
Цель. Изучение влияния терапии тиреоидными гормонами на регрессию диффузной мастопатии и ее связи с овуляторной функцией у пациенток, находящихся в состоянии эутиреоза. Организация исследования v проспективное исследование.
Учреждение. Поликлиника.
Материалы. 97 женщин с диффузной мастопатией в эутиреозе с концентрацией кортизола в пределах нормы, не пользовавшихся препаратами, влияющими на функцию гипоталамо-гипофизарно-яичниковой системы и другими лекарственными средствами, способными повлиять на фармакодинамику тироксина или на его эффективность, беременные, кормящие грудью, пациентки с фиброзной формой мастопатии и сопутствующими заболеваниями, при которых терапия тиреоидными гормонами противопоказана.
Методы исследования. Проводились рентгенологическая и ультразвуковая маммография, ультразвуковое исследование (УЗИ) щитовидной железы, органов малого таза. Определялась концентрация Т3, Т4, ТТГ, титра антител к тиреоглобулину, ФСГ, ЛГ, пролактина, эстрадиола, прогестерона, дегидроэпиандростерона. После окончания курса терапии, средней продолжительностью 3,4+0,02 месяца, L-тироксином в средней суточной дозе 138+1 мкг обследование было повторено. Для статистической обработки полученных данных нами использовались общепринятые параметрические и непараметрические методы исследования корреляционных связей.
Результаты. Результативность терапии тиреоидными гормонами диффузной мастопатии составляет от 54 до 93% и зависит от выбранной группы пациенток находится в обратной зависимости от концентрации дегидроэпиандростерона до лечения, и в прямой зависимости от частоты нормальных овуляторных циклов при лечении, коррелирующей с концентрацией ТТГ на фоне терапии.
Вывод. Нарушение овуляторной функции и эутиреоидный является фоном для развития мастопатии. Лечение тиреоидными гормонами влияет на процессы стероидогенеза, определяющего результативность терапии мастопатии.
Введение. В настоящее время несмотря на многочисленные проведенные исследования, патогенез мастопатии окончательно не ясен. Предполагают, что в основе развития мастопатии лежит повышение концентрации тех или иных гормонов и факторов роста в крови [1,8,11,12,16]. Возможно, причиной является повышение чувствительности рецепторов эпителия долек и протоков молочных желез, эндокринных желез к гормонам [11,12,14,19,25]. Не исключено, что диспластические процессы определяются той гормональной и биохимической средой, которая синтезируется измененными эпителием и стромой молочных желез [23,24,26,27]. Влияние гормонов на развитие мастопатии связывают с действием факторов роста [9,20,21].
Однако, большинство авторов считает, что ведущая роль в развитии
мастопатии принадлежит нарушению овуляторной функции [4,5,11,12].
Развитие мастопатии при нормальной концентрации гормонов в крови
R.J.Santen [27] и W.R. Miller [23] объясняют локальной гиперэстрогенгистией,
вызванной повышением активности ароматазы в ткани молочной железы,
обеспечивающей ароматизацию андрогенов в эстрогены. Кроме того,
качественный и количественый состав рецепторов эпителия долек
и протоков молочных желез,а также эндокринных желез могут существенно
повлиять на развитие мастопатии [11,12,14,17,19,22,25]. По данным
Л.М.Бурдиной [1] клиническая форма мастопатии зависит от гормонального
статуса женщины.
Кроме того, установлено, что мастопатия развивается вследствии
нарушения не только функции репродуктивной системы, но и других
эндокринных желез [2,4,5,6,8,9,10,11,19,29]. Развитие мастопатии
может происходить на различном фоне тиреоидной активности [4,6,8,10,11,30].
По мнению большинства авторов, щитовидная железа оказывает влияние
на развитие мастопатии опосредованно: через нарушение функции
яичников [4,6,11]. По всей видимости, трийодтиронин (Т3) влияет
на биохимические процессы в клетке и определяет ароматазную активность
цитохрома Р-450 и, следовательно, стероидогенез (в том числе и
в ткани молочных желез) [7].
С другой стороны, имеются данные, указывающие на способность овуляторной
функции оказывать существенное влияние на развитие эутиреоидного
зоба [3,8,13].
В связи с неизученностью патогенеза мастопатии, противоречивостью
данных о влиянии функции щитовидной железы и овуляторной функции
на развитие мастопатии, достаточно высокой сочетаемости мастопатии,
эутиреоидного зоба и нарушения овуляторной функции целью нашего
иследования стало изучение влияния терапии тиреоидными гормонами
на регрессию диффузной мастопатии и ее связи с овуляторной функцией
у пациенток, находящихся в состоянии эутиреоза.
Материалы и методы исследования. Было обследовано 97 пациенток
с диффузной мастопатией в состоянии эутиреоза, не пользовавшихся
препаратами, влияющими на функцию гипоталамо-гипофизарно-яичниковой
системы и другими лекарственными средствами, способными повлиять
на фармакодинамику тироксина или на его эффективность: беременные,
кормящие грудью, пациентки с фиброзной формой мастопатии и сопутствующими
заболеваниями, при которых терапия тиреоидными гормонами противопоказана.
Всем больным были проведены рентгенологическая (на 7-10 дни менструального
цикла) и ультразвуковая (на 5-7 дни менструального цикла) маммографии.
Размеры щитовидной железы определялись с помощью ультразвукового
исследования. Использовалась ультразвуковая классификация зоба.
Концентрация гормонов в крови Т3, Т4, тиреотропного гормона, титр
антител к тиреоглобулину определялись иммунорадиометрическим методами
с помощью наборов фирмы IMMUNOTECH. Чувствительность иммунорадиометрического
набора тиреотропного гормона (TSH Irma IMMUNOTECH ) - 0,025мМЕ/л.
Исследование концентрации в крови пролактина, фолликулостимулирующего
гормона (ФСГ), лютеинизирующего гормона (ЛГ), эстрадиола, прогестерона,
дегидроэпиандростерона (ДЭАС), кортизола, выполнены лабораториями
иммуно-ферментного анализа с использованием моноклональных антител.
Эстрадиол, прогестерон исследовали в фазу расцвета желтого тела.
Пролактин, ФСГ,ЛГ,ДЭАС v на 5-7 дни менструального цикла. Забор
венозной крови осуществлялся через 2 часа после пробуждения натощак.
Овуляторную функцию оценивали, используя результаты гормональных
исследований, данные ультразвукового исследования органов малого
таза на 5-7 дни менструального цикла и измерения базальной температуры.
После обследования всем женщинам было назначено лечение L-тироксином
в высоких максимально-переносимых дозах от 75-175 мкг/сут (средняя
доза 138+1 мкг/сут), курсом от 3 до 5 месяцев (в среднем 3,4+0,02
месяца). В конце курса терапии было проведено повторное обследование.
Оценка ремиссии мастопатии проводилась по данным рентгенологической
маммографии. При сравнении рентгенологических маммограмм до и
после лечения определялась динамика площади и интенсивности затенения.
В онкологической практике существует понятие частичной и полной
ремиссии: полная - при динамике опухоли на 50% и больше, частичная
v от 25 до 49%. Отсутствие ремиссии v при изменении патологического
очага меньше, чем на 25%. С целью количественной оценки ремиссии
было введено понятие результативности терапии, то есть частоты
встречаемости ремиссии в результате лечения. Качество лечения
определялось с помощью вычисления коэффициента корреляции рангов
Спирмена. Выяснялась корреляция между динамикой мастопатии, выражаемой
в процентах 0%, 25% и 50%, (качеством лечения) и другими исследуемыми
параметрами.
Динамику овуляторной функции определяли по формуле:
Овуляторная функция в конце курса лечения v Овуляторная функция до лечения
Овуляторную функцию оценивали по трехбальной системе: нормальный овуляторный цикл- 2 балла, недостаточность лютеиновой фазы (НЛФ) -1, ановуляция v0.
Для определения интенсивности динамики параметра использовалась формула:
(1 - параметр в конце курса терапии ) *100%
--------------------------------------------------------------
параметр до лечения
Для статистической обработки полученных данных нами использовались
общепринятые параметрические и непараметрические методы исследования
корреляционных связей. Корреляционый анализ проводился с использованием
доверительной вероятности, больше 95,5%
Результаты исследования и их обсуждение. Из 97 обследованных женщин
с диффузной мастопатией у 28% имелся диффузный или диффузно-узловой
зоб, у 24 % - узел щитовидной железы, а у 48% щитовидная железа
нормальных размеров без узлов, при этом содержание гормонов щитовидной
железы независимо от наличия или отсутствия эутиреоидного зоба
оказалось одинаковым. Средняя концентрация гормонов : Т3 = 4,4+0,1нмоль/л
(норма 2,5-5,8нмоль/л), тироксина(Т4)= 17,6+0,4 нмоль/л (норма
11,5-23нмоль/л), ТТГ= 1,7+0,1мМЕ/л (норма 0,17-4,07 мМЕ/л), титр
антител к тиреоглобулину 25+6 единиц (норма 0-50 единиц).
В зависимости от вида овуляторной функции были выделены группы
с ановуляцией, недостаточностью лютеиновой фазы (НЛФ), нормальным
овуляторным циклом. В каждой группе женщин выделили три возрастные
подгруппы: I v от 18 до 25лет; II v от 26 до 44 лет; III- от 45
до 55 лет. Средние значения концентраций гормонов, отражающих
функционирование гипоталамо-гипофизарно-яичниковой системы, пациенток
с диффузной мастопатией при разной овуляторной функции в трех
возрастных подгруппах представлены в таблице 1. Во всех возрастных
подгруппах женщин с разным характером овуляторного цикла средние
значения концентрации пролактина, эстрадиола, прогестерона, ФСГ,
ЛГ, ДЭАС находились в пределах нормы и различие их было несущественным,
за исключением низкой cредней концентрации прогестерона в группе
с ановуляцией. Средние концентрации ФСГ и ЛГ в III возрастной
подгруппе у женщин с ановуляцией оказались у верхней границы нормы,
что можно объяснить пременопаузальным периодом, для которого характерно
снижение толерантности аденогипофиза к эстрадиолу и прогестерону.
Выявленное в нашем исследовании одинаковое содержание в крови
гормонов щитовидной железы у пациенток с матопатией при разных
клинических формах эутиреоидного зоба и без него, а также несущественное
различие в содержании гормонов, определяющих функционирование
гипоталамо-гипофизарно-яичниковой системы, находящихся в пределах
нормы, за исключением прогестерона, опровергает точку зрения некоторых
авторов, утверждающих, что в основе развития мастопатии лежит
абсолютное или относительное повышение концентрации гормонов щитовидной
железы, эстрадиола, прогестерона, ФСГ, ЛГ, пролактина [4,5,6,11].
Нарушение овуляторной функции и эутиреоидный зоб, по-видимому,
создают условия для развития мастопатии, но не определяют его.
После проведенного обследования 97 пациенткам с диффузной мастопатией
было проведено лечение L-тироксином в течении 3-5 месяцев, в результате
которого у 79% пациенток уровень ТТГ оказался меньше 0,17мМЕ/л.,
что расценивалось как медикаментозный тиретоксикоз. У 21% больных
уровень ТТГ оказался выше 0,17мМЕ/л, но был у нижней границы нормы,
что трактовалось, как супрессивная терапия без тиреотоксикоза.
Проведенная оценка влияния терапии тиреоидными гормонами на овуляторную
функцию, показала, что средние концентрации эстрадиола и прогестерона
до и на фоне лечения достоверно различаются, за исключением концентрации
эстрадиола в группе с ановуляцией (табл.2). Причем в процессе
терапии средние концентрации эстрадиола стали меньше, а прогестерона
увеличились по сравнению с фоновыми. Однако, при дальнейшем изучении
нами не было выявлено четкой зависимости интенсивности динамики
эстрадиола и прогестерона от концентрации ТТГ в крови на фоне
терапии. Только в группе пациенток с НЛФ была обнаружена слабая
обратная корреляционная связь между интенсивностью сниженияконцентрации
эстрадиола и концентрацией ТТГ на фоне терапии ( v0,26). У женщин
с нормальной овуляторной функцией отмечена слабая прямая зависимость
интенсивности уменьшения концентрации прогестерона от концентрации
ТТГ в крови на фоне терапии (0,31). Выявлена обратная зависимость
концентрации прогестерона от ТТГ в крови на фоне терапии в группе
пациенток с НЛФ (-0,28). При этом была выявлена обратная зависимость
частоты нормальных овуляторных циклов от концентрации ТТГ в крови
на фоне терапии, представленная на рисунке 1. Все обследованные
больные были разделены на 2 группы: пациентки с нормальными размерами
щитовидной железы без узлов и с зобом. В каждой группе пациенток
выделены подгруппы в зависимости от результатов проводимой супрессивной
терапии: с медикаментозным тиреотоксикозом и без тиреотоксикоза.
При супрессивной терапии с тиреотоксикозом частота нормальных
овуляторных циклов оказалась выше (в среднем 42,5%, то есть в
пределах от 40 до 45%), чем в группе с ТТГ> 0,17мМЕ/л (в среднем
36%, то есть в пределах от 33 до 39%). У пациенток с зобом нормальная
овуляторная функция на фоне терапии встречается чаще, по сравнению
с пациентками без зоба.
Анализ полученных данных показал, что на фоне проводимого лечения
результативность терапии мастопатии находилась в обратной зависимости
от концентрации ТТГ в крови (рис. 1). В группе женщин с супрессивной
терапией L-тироксином без тиреотоксикоза результативность терапии
была ниже (в среднем 66,5% и находилась в пределах от 58% до75%),
чем в группе с более низкой концентрацией ТТГ на фоне терапии
(в среднем 78% и находилась в пределах от 71% до 85%). У пациенток
с зобом результативность терапии мастопатии была выше, чем у женшин
с щитовидной железой нормальных размеров.Четкой корреляционной
зависимости качества лечения мастопатии от концентрации ТТГ на
фоне терапии не обнаружено.
Изучение зависимости результативности терапии мастопатии от овуляторной
функции яичников показало, что результативность лечения и качество
лечения мастопатии зависят не только от характера овуляторной
функции до и в конце курса лечения, но и от особенностей динамики
овуляторной функции в процессе лечения. Выявлена прямая зависимость
результативности терапии тиреоидными гормонами мастопатии с частотой
нормальных овуляторных циклов в конце курса терапии (рис.1), а
также от частоты циклов с сохраненной и нормальной овуляторной
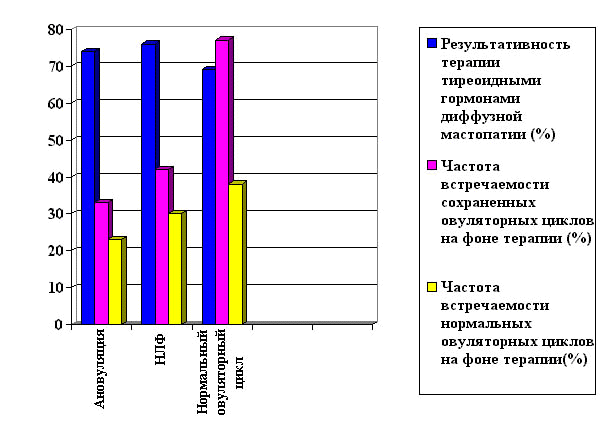
функцией (рис.2). В группе женщин с нормальной овуляторной функцией
до лечения овуляторная функция оказалась сохраненной в процессе
терапии у 77 % женщин, при этом нормальная овуляторная функция
в конце курса терапии встречалась с наибольшей частотой v у 38%,
а результативность терапии мастопатии оказалась наименьшей и составила
69%. У женщин с НЛФ до лечения результативность терапии мастопатии
была максимальная 76%, ей соответствовала частота нормальных овуляторных
циклов на фоне терапии 30%, и 42% сохраненных овуляторных циклов.
У пациенток с ановуляцией до лечения в 33% случаев появилась овуляция,
а у 23% восстановилась авуляторная функция до нормальной. Минимальному
проценту циклов с сохраненной и нормальной овуляторной функцией
соответствовала достаточно высокая результативность терапии мастопатии
74% (рис.2). При делении пациенток на группы в зависимости от
концентрации ТТГ на фоне терапии L-тироксином (рис.1) минимальной
частоте нормальных овуляторных циклов (33%) соответствовала наименьшая
результативность терапии мастопатии ( 58%), а максимальной частоте-45%
- наибольшая результативность терапии мастопатии v85% (рис.1).
Таким образом, результативность терапии мастопатии зависит не
только от частоты нормальных овуляторных циклов на фоне терапии,
но и от других факторов, которые, по-видимому, влияют на овуляторную
функцию: концентрации ТТГ на фоне терапии, наличия зоба.
Качество лечения мастопатии находится в прямой зависимости от
динамики овуляторной функции (в пределах от 0,23 до 0,64). То
есть количественный и качественный показатели лечения мастопатии
выше при более выраженных изменениях овуляторной функции. Необходимо
отметить, что выявлена прямая корреляционная зависимость качества
терапии мастопатии от интенсивности уменьшения концентрации эстрадиола
только у пациенток с нормальным овуляторным циклом до лечения.С
0,32. То есть чем меньше концентрация эстрадиола, тем чаще наблюдалась
полная ремиссия мастопатии. В группе с НЛФ выявлена сильная обратная
зависимость качества терапии мастопатии от интенсивности уменьшения
концентрации прогестерона (-0,89). То есть чем больше увеличилась
концентрация прогестерона в процессе терапии, тем чаще наблюдалась
полная ремиссия мастопатии. При этом соотношение между эстрадиолом
и прогестероном при лечении в группе с НЛФ соответственно уменьшалось,
о чем свидетельстует коэффициент корреляции рангов Спирмена, равный
0,41. В группе с ановуляцией до лечения слабая обратная корреляционная
связь между качеством лечения мастопатии и соотношением эстрадиола
и прогестерона стала сильной с -0,73. Таким образом, результативность
терапии мастопатии зависит от динамики овуляторной функции, частоты
встречаемости сохраненных овуляторной функции и частоты нормальной
овуляторной функции при лечении. При этом у пациенток с нормальным
овуляторным циклом снижается концентрация эстрадиола, в группе
с НЛФ повышается концентрация прогестерона и, соответственно,
снижается соотношение между эстрадиолом и прогестероном. В группе
с ановуляцией до лечения ремиссия мастопатии также зависит от
изменения овулятоной функции. У женщин с исходной ановуляцией
в небольшом проценте (23%) случаев восстанавливается овуляторная
функция до нормальной.
Для изучения зависимости качества лечения L-тироксином мастопатии
от концнтрации ТТГ в крови и изменения овуляторной функции в процессе
лечения были выделены 2 группы женщин: c полной ремиссией мастопатии
(53 человека со средним возрастом 36,3+1,37лет) и отсутствием
ремиссии мастопатии (26 женщин со средним возрастом 36,5+1,67
лет). В группе с полной ремиссией мастопатии супрессивная тпрапия
с медикаментозным тиреотоксикозом проводилась у 79% женщин, при
этом средняя концнентрация ТТГ в крови на фоне терапии оказалась
равной 0,16мМЕ/л. В группе с отсутствием ремиссии мастопатии супрессивная
терапия с тиреотоксикозом проводилась у 54% женщин, со средней
концентрацией ТТГ в крови в процессе лечения 0,19+0,11мМЕ/л, что
подтверждает выявленную ранее закономерность: качество лечения
мастопатии выше при супрессивной терапии с тиреотоксикозом, чем
без него). В группе с полной ремиссией мастопатии в процессе лечения
нормализованная овуляторная функция наблюдалась чаще (в 42% случаев),
чем в группе с отсутствием ремиссии мастопатии (в 12% случаев).
При этом полная ремиссия сопровождалась более низкой средней концентрацией
эстрадиола (262,3+45,11 пмоль/л), чем отсутствие ремиссии мастопатии
(381,8+152,09пмоль/л). Концентрация эстрадиола существенно уменьшилась,
т.е.более чем на 25%, в группе с полной ремиссией у 62% женщин
(в среднем уменьшилась на 22,5+19,52%). В группе с отсутствием
ремиссии концентрация эстрадиола уменьшилась более чем на 25%
только у 12% женщин (в среднем в группе она увеличилась на 20,9+41,21%).
Таким образом, качество лечения находится в обратной зависимости
от концентрации эстрадиола в процессе лечения и в прямой зависимости
от интенсивности уменьшения концентрации эстрадиола, что также
коррелирует с концентрацией ТТГ в процессе лечения. Существенной
разницы в средней концентрации прогестерона в группах с полной
ремиссией и ее отсутствием не было выявлено. Однако, при полной
ремиссии мастопатии концентрация прогестерона увеличилась более
чем на 25% у 40% женщин (в среднем увеличилась на 132,1+129,58
%). В то время как при отсутствии ремиссии концентрация прогестерона
существенно увеличилась в процессе лечения только у 19% женщин
( в среднем на 1,2+71,31%). Среднее соотношение эстрадиола и прогестерона
в процессе лечения у женщин с достигнутой полной ремиссией было
меньше ( 29+11,46), чем при отсутствии ремиссии (51,9+15,29).
Таким образом, качество лечения мастопатии зависит от динамики
овуляторной функции: изменеия концентрации эстрадиола, прогестерона,
их соотношения. У женщин репродуктивного периода в группах с полной
ремиссией мастопатии на фоне терапии L-тироксином прослеживается
тенденция к нормализации овуляторной функции. У женщин в пременопаузальном
периоде в группе с полной ремиссией мастопатии при терапии L-тироксином
отмечен переход к ановуляции. Существующая точка зрения о том,
что ДЭАС является гормоном, определяющим течение пролиферативных
процессов в молочных железах как доброкачественных нашла подтверждение
при наших исследованиях. Возможно, ДЭАС определяет переход железистой
формы мастопатии в фиброзную форму. Результативность терапии диффузной
мастопатии тиреоидными гормонами оказалась значительно выше при
повышенных концентрациях ДЭАС до лечения (91%), чем при пониженных
(53%).
На основании вышеизложенного можно сделать следующее заключение:
динамика овуляторной функции в процессе лечения L-тироксином,
а именно изменение концентрации эстрадиола и прогестерона, - определяет
результативность терапии диффузной мастопатии. Вероятно, тиреоидные
гормоны изменяя активность ароматизации цитохрома Р-450, влияют
на стероидогенез, в том числе и непосредственно в ткани молочных
желез. При нарушении ароматизации андростендиона в эстрадиол можно
ожидать повышение концентрации андростендиона в крови и в ткани
молочной железы. Вероятно, тиреоидные гормоны влияют на пролиферирующий
эпителий молочных желез опосредованно через эстрадиол, прогестерон,
андростендион , который в свою очередь определяет активность факторов
роста, контролирующих процессы пролиферации эпителия и соединительной
ткани в молочных железах [1,2,7,8,9,12,13,15,17,18,23,27,28].
Выводы. Нарушение овуляторной функции и эутиреоидный зоб является
фоном для развития мастопатии. Лечение тиреоидными гормонами влияет
на стероидогенез, определяющего результативность терапии мастопатии.
Авторы.
Доктор медицинских наук
доцент кафедры факультетской терапии СПбГМУ
имени акад.И.П.Павлова
Красильникова Е.И.
Эндокринолог " Маммологического центра" поликлиники
¦32
196657, Санкт-Петербург, Колпино, ул. В.Слуцкой, д.89, к.2, кв.62.
тел (812)-481-4286
Горюшина О.Г.
Литература.
1. Бурдина Л.М. Клинико-рентгенологические особенности заболеваний молочных желез у гинекологических больных репродуктивноговозраста с нейро-эндокринной патологией./ Автореф. дис. докт . мед.наук..-М.-1993. - с.
2. Горюшина О.Г. Occurence of nontoxic goiterin patients with mastopathy(Частота встречаемости диффузно-нетоксического зоба у пациенток смастопатией) // Журнал акушерства и женских болезней ,1999,том XLVIII v 1специальный выпуск-С.70
3. Зигизмунд В.А., Садыкова М.Ш.,Самойлова О.Н.,Моисеева О.М. Влияние комбинированных оральных контрацептивов на гипофизарно-тиреоидную и гипофизарно-надпочечниковую системы женщин с различным анатомическим состоянием щитовидной железы // Акушерство и гинекология v 1988.- ¦ 11-С.50-53.
4. Ильин А.Б., Бескровный С.В. Молочная железа v орган репродуктивной системы женщины/ Журнал акушерства и женских болезней.-2000.-т. т. XLIX - выпуск2 -С.51-53
5. Кира Е.Ф., Бескровный С.В., Ильин А.Б. и др. Влияние препаратов гестагенового ряда на морфо-функциональное состояние молочных желез //Журнал акушерства и женских болезней.-2000.-т. т. XLIX - выпуск2 -С.75-83
6. Кузьмин И.А. Состояние тиреоидной и репродуктивной функции у больных с доброкачественными заболеваниями и раком молочной железы. Автореф. дис. канд.мед.наук.-Л.-1991.- с.
7. Рябцева И.Т.,Шаповалова К.А.,Ильина Г.Ф.,Лескова Г.Е.,Горюшина О.Г. ГБО в терапии ранних токсикозов беременных Тезисы докладов III Всеармейской научно-практической конференции по баротерапии "Баротерапия в комплексном лечении и реабилитации раненых, больных и пораженных", 28-29 мая, 1997-С. 35-36
8. Самунджан Е.М.,Горевая А.Н.,КартавоваН.С и др. Дисгормональные гиперплазии молочной железы.-Киев:Наукова думка,1979.- 160 с.
9. Семиглазов В.Ф., Веснин А.Г., Моисеенко В.М. Минимальный рак молочной железы,Профилактика, выявление, лечение. v С-Пб, Гиппократ- 1992-232с.
10. Серов В.Н.,Прилепская В.Н.,Пшеничникова Т.Я. и др Практическое руководство по гинекологической эндокринологии.-М.:Русфармамед,1995.-с.426.
11. Сидоренко Л.Н. Мастопатия.-Л.:Медицина,1991.- 263с.
12. Сметник В.П.,Тумилович Л.Г. Неоперативная гинекология./Руководство для врачей.Книга N2.-С-Пб.:Сотис,1995.-201с.
13. Теппермен ДЖ.,Теппермен Х. Физиология обмена веществ и эндокринной системы./Пер.с англ.В.И.Кандора.Под ред.Я.И.Аджипы.-М.:Мир 1989.-653с.
14. Хосталек У. Заболевания щитовидной железы и возможности их эффективного лечения.//Тиреоид.Россия/Сборник избранных лекций ведущих эндокринологов Европы.-1997.-С.6-9.
15. Щеплягина Л.А. Медико-социальные последствия роста напряженности зобной эндемии для детей и подростков.//Тиреоид.Россия./Сборник избранных лекций ведущих эндокринологов Европы.-1997.-С.41-42.
16. Abney T.O.,Teran A.Z.,Mahesh V.B. et al Fibrocystic breast disease :the significance of beta-human chorionic gonadotropin and other polypeptides in breast cyst fluid.//Fertility & Sterility.-1988.-Vol.49,N4.-P.638-643.
17. Alvarado-Pisani A.R.,Chacon R.S.,Betancourt L.J.,Lopez-Herrera L. Thyroid hormone receptors in human breast cancer: effect of thyroxine administration.//Anticancer Research.-1986.-Vol.6,N6.-P.1347- 1351.
18. Forsyth I.A. The mammary gland.//Baillieres Clinical Endocrinology & Metabolism.-1991.-Vol.5,N4.-P.809-832.
19. Dogliotti L.,Faggiuolo R.,Ferusso A et al. Prolactin and thyrotropin response to thyrotropin-releasing hormone in premenopausal women with fibrocystic disease of the breast.//Hormone Research.-1985.-Vol.21,N3.-P.137-144.
20. Fernandez-Pol J.A.,Hamilton P.D.,Klos D.J. Transcriptional regulation of proto-oncogene expression by epidermal growth factor, transforming growth factor beta 1, and triiodothyronine in MDA-468 cells.//Journal of Biological Chemistry.-1989.-Vol.264,N7.-P.4151- 4156.
21. Forsyth I.A. The mammary gland.//Baillieres Clinical Endocrinology & Metabolism.-1991.-Vol.5,N4.-P.809-832.
22. Horwitz K.B. Progestins and hormonal carcinogenesis / Book of abstracts . International conference hormonal carcinogenesis : mechanisms and prevention-May 15-16, 2000.
23. Miller W.R. Aromatase and breast cancer / Book of abstracts . International conference hormonal carcinogenesis : mechanisms and prevention-May 15-16, 2000.
24. Ness J.C.,Sedghinasab M.,Moe R.E.,Tapper D. Indentification of multiple proliferative growth factors in breast cyst fluid.// American Journal of Surgery.-1993.-Vol.166,N3.-P.237-243
25. Peters F.,Pickardt C.R.,Breckwoldt M. Thyroid hormones in benign breast disease. Normalization of exaggerated prolactin responsiveness to
thyrotropin-releasing hormone.//Cancer.-1985.- Vol.56,N5.-P.1082-1085.
26. .Pollak M. IGF-1 physiology : influence on cancer risk. / Book of abstracts . International conference hormonal carcinogenesis : mechanisms and prevention-May 15-16, 2000
27. Santen R.J. Mechanisms of estrogen-induced carcinogenesis and prevention of breast cancer/
28. Thalabard J.C.,Sitruk-Ware R.,Kutttenn F.,Mauvais-Jarvis P. Endocrine markers in benign breast disease.//Zentrallblatt fur Gynakologie.-1986.-Vol.108,N6.-P.354-358.
29. Zhou-Li F.,Albaladejo V.,Joly-Pharaboz M.O. et al. Antiestrogens prevent the stimulatory effects of L-triiodothyronine on celle proliferation.//Endocrinology.-1992.-Vol.130,N3.-P.1145-1152.
30. Zumoff B.,O'Connor J.,Levin J et al. Plasma levels of thyroxine
and triiodothyronine in women with breast cancer.//Anticancer
Research.-1981.-Vol.1,N5.P.287-291.
Об авторах.
Горюшина О.Г., 1969г.р., закончила 1ЛМИ им.акад. И.П.Павлова в 1993г.
С 1993 по 2001 год обучалась в интернатуре по акушерству и гинекологии, ординатуре по эндокринологии, на курсах повышения квалификации "Методы диагностики и лечения злокачественных опухолей", "Эндокринология репродукции", "Первичная специализация по ультразвуковой диагностике", "Ультразвуковая диагностика в акушерстве и гинекологии". "Лучевая диагностика заболеваний молочных желез". Имеет публикации. Работает в "Маммологическом центре" поликлиники ¦ 32 эндокринологом, в поликлинике ¦ 95 гинекологом-эндокринологом.
Красильникова Е.И., 1954 г.р., доктор медицинских наук, доцент
кафедры факультетской терапии СПбГМУ им.акад.И.П.Павлова. Имеет
публикации.
Таблица 1.
Средние значения концентраций пролактина, фолликулостимулирующего и лютеинизирующего гормонов, эстрадиола и прогестерона в крови пациенток с диффузной мастопатией при разной овуляторной функции в трех возрастных подгруппах.
|
|
|
|
(мМЕ/л) |
|
|
(пмоль/л) |
|
(нмоль/л) |
|
Нормальный овулято-рный цикл |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Таблица 2.
Результативность терапии диффузной мастопатии и динамика концентрации
эстрадиола, прогестерона, ТТГ в крови.
| Хар-р овуля-торной ф-ии |
Число пац. |
РТМ |
|
||||
|
|
|
ТТГ на
фоне лечения (мМЕ/л) |
|||||
| до лечения |
|
|
|
||||
| Норм |
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
| Ановуляция |
|
|
|
|
|
|
|
|
|
|
||||||
РТМ-Результативность терапии мастопатии(%)
Рисунок 1.
Зависимость результативности терапии тиреоидными гормонами диффузной
мастопатии от частоты встречаемости нормальных овуляторных циклов,
концентрации ТТГ при лечении.
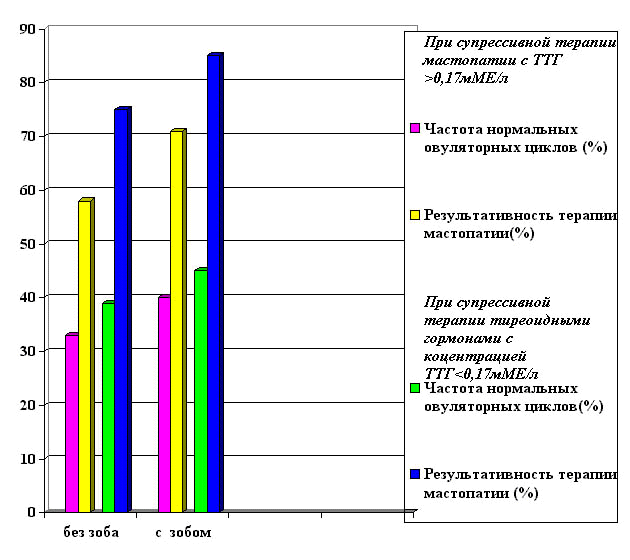
Рисунок 2.
Зависимость результативности терапии тиреоидными гормонами диффузной
мастопатии от частоты встречаемости сохраненных овуляторных циклов
на фоне терапии.