Фармакология - Сравнительная эффективность монотерапии меропенемом и комбинации цефтазидима с амикацином в режиме эмпирической терапии при трансплантации костного мозга
Г.А. Клясова, В.Г. Савченко, Л.С. Любимова, Л.П. Менделеева, Е.Н. Паровичникова, Т.В. Толкачева, Н.А. Петрова, Б.В. Зингерман, Ю.Ю. Гудилина
Гематологический научный центр, Москва
Современная высокодозная химиотерапия сопряжена с высоким риском развития инфекционных осложнений, течение которых может быть фатальным, если эмпирическая антибактериальная терапия в период критической нейтропении не начата вовремя, при первых же признаках инфекции. В этих случаях назначают антибиотики широкого спектра действия и наиболее часто используемой комбинацией является сочетание цефалоспоринов III поколения с аминогликозидами. Такая комбинация антибиотиков характеризуется синергидным действием в отношении грамотрицательных микробов и меньшей вероятностью появления резистентности. Однако применение аминогликозид - содержащих режимов не лишено недостатков. Отрицательной стороной использования комбинации аминогликозидов с бета-лактамами является большая частота развития токсических эффектов (гипокалиемия, поражение почек, печени), необходимость проведения мониторинга концентраций аминогликозидов в крови, и, что крайне важно, имеется высокий риск развития сочетанной токсичности, особенно при использовании средств с аналогичным побочным действием, например, амфотерицина В, циклоспорина А, ацикловира, ванкомицина, назначение которых не является редкостью, особенно при трансплантации костного мозга. Вероятность развития токсических осложнений и нежелательных взаимодействий между используемыми препаратами может быть снижена при лечении инфекций одним антибиотиком, обладающим большей активностью в отношении грамотрицательных бактерий, в том числе синегнойной палочки, а также и в отношении грамположительных бактерий. В этиологической структуре инфекционных осложнений нейтропении на долю грамположительных бактерий в настоящее время приходится 60-70%. Этим требованиям отвечают карбапенемы - имипенем/циластатин и меропенем - антибиотики с наиболее широким спектром антибактериальной активности [1, 2]. При назначении этих препаратов уменьшается необходимость в дополнительном присоединении иных антибактериальных средств.Таблица 1. Характеристика больных, включенных в исследование
|
Характеристика |
Меропенем |
Цефтазидим + Амикацин |
| Число больных |
22 |
20 |
| Число случаев |
23 |
20 |
| Возраст, медиана (диапазон) |
31 (16-43) |
36 (15-50) |
| Пол: мужчины |
9 |
13 |
| женщины |
13 |
7 |
| Нозологическая форма заболевания: | ||
| хронический миелолейкоз |
13 |
12 |
| лимфогранулематоз | 5 |
2 |
| острый миелоидный лейкоз |
3 |
3 |
| острый лимфоидный лейкоз | - |
1 |
| лимфосаркома |
1 |
1 |
| рак молочной железы | - |
1 |
| Аутологичная трансплантация | ||
| костного мозга/стволовых клеток крови |
11 (2/9) |
11 (4/7) |
| Аллогенная трансплантация костного мозга |
12 |
9 |
| Нейтропения (лейкоцитов < 1 . 109/л) |
22/23 |
20/20 |
| Длительность нейтропении в целом, медиана (диапазон) |
13 (6-108) |
15,5 (7-41) |
| Длительность нейтропении при лечении антибиотиками, медиана (диапазон) |
8 (5-13) |
11,5 (3-26) |
| Число лейкоцитов при назначении антибиотиков |
0,2 (0,1-1,1) |
0,3 (0,1-3,5) |
| Число лейкоцитов при окончании лечения антибиотиками |
1,3 (0,7-6,3) |
1,3 (0,8-2,6) |
| Селективная деконтаминация кишечника: |
21/23 |
20/20 |
| Ципрофлоксацин |
19/21 |
17/20 |
| Триметоприм/сульфаметоксазол |
1/21 |
2/20 |
| Полимиксин В |
1/21 |
- |
| Офлоксацин |
- |
1/20 |
| Противогрибковая профилактика: |
23/23 |
19/20 |
| Флуконазол |
23 |
20 |
| Амфотерицин В |
- |
1 |
| Противовирусная профилактика: |
3/23 |
2/20 |
| Ацикловир |
3 |
2 |
| Центральный венозный катетер |
23 |
20 |
Таблица 2. Основания для назначения антибиотиков
| Показатель | Меропенем | Цефтазидим + Амикацин |
| Лихорадка неясного генеза |
19 (83%) |
14 (70%) |
| Стоматит |
14 (61%) |
11 (55%) |
| Стоматит+ некротическая энтеропатия |
2 (9%) |
2 (10%) |
| Микробиологически доказанная инфекция |
1 (4%) |
2 (10%) |
| Инфильтрат в области промежности |
- |
1 |
| Инфекция мочевыводящих путей |
- |
1 |
| Бактериемия |
1 |
- |
| Клинически доказанная инфекция (пневмония) |
3 (13%) |
4 (20%) |
Таблица 3. Результаты лечения
|
Показатель |
Меропенем |
Цефтазидим + Амикацин |
| Излечение (антибиотики I этапа) |
15/23 (65%) |
10/20 (50%) |
| Нормализация температуры через 72 ч |
10/23 (43,5%) |
4/20 (20%) |
| Модификация лечения в течение первых 72 ч |
2/23 (9%) |
5/20 (25%) |
| Излечение с модификациями |
8/23 (35%) |
10/20 (50%) |
| + ванкомицин |
5/23 (22%) |
4/20 (20%) |
| +ампициллин/сульбактам |
- |
3/20 (15%) |
| из них с эффектом |
2/5* |
1/7* |
| +амфотерицин В |
6/23 (26%) |
9/20 (45%) |
| Повторное назначение антибиотиков |
2/23 (9%) |
4/20 (20%) |
| Дни** |
24, 35 |
8, 15, 21, 32 |
|
* В остальных случаях
потребовалось присоединение амфотерицина В. ** С момента окончания лечения. | ||
Таблица 4. Результаты лечения в зависимости от вида трансплантации костного мозга
|
Показатель |
Меропенем |
Цефтазидим + Амикацин |
| Аутологичная |
n=11 |
n=11 |
| Излечение (антибиотики I этапа) |
6/11 (55%) |
5/11 (45%) |
| Нормализация температуры через 72 ч |
2/11 (18%) |
1/11 (9%) |
| Излечение с модификациями |
5/11 (45%) |
6/11 (55%) |
| + ванкомицин |
3/11 (27%) |
4/11 (36%) |
| из них с эффектом |
1/3 |
1/4 |
| +амфотерицин В |
4/11 (36%) |
5/11 (45%) |
| Повторное назначение антибиотиков |
1/11 (9%) |
1/11 (9%) |
| Аллогенная |
n=12 |
n=9 |
| Излечение (антибиотики I этапа) |
9/12 (75%) |
5/9 (56%) |
| Нормализация температуры через 72 ч |
8/12 (67%) |
3/9 (33%) |
| Излечение с модификациями |
3/12 (25%) |
4/9 (44%) |
| + ванкомицин |
2/12 (25%) |
3/9 (33%) |
| из них с эффектом |
1/2 |
0/3 |
| +амфотерицин В |
2/12 (17%) |
4/9 (44%) |
| Повторное назначение антибиотиков |
1/12 (8%) |
3/9 (33%) |
Эффективность меропенема в режиме монотерапии, изученная в большом числе контролируемых исследований, составляет 48-56% [2-5]. Однако эти исследования практически не охватывали или включали ограниченное (до 15%) число больных после трансплантации костного мозга [5]. Цель настоящего рандомизированного исследования - оценить эффективность применения меропенема в сравнении с комбинацией цефтазидима и амикацина у наиболее тяжелой группы пациентов - после трансплантации аллогенного и аутологичного костного мозга.
Материалы и
методы
В
исследование включены пациенты, которым была проведена
трансплантация аллогенного или аутологичного костного
мозга (или стволовых клеток крови).
Всем больным проводили селективную
деконтаминацию кишечника, в основном ципрофлоксацином,
по 250 мг 2 раза в день, перорально, с первого дня
режима кондиционирования (высокодозной химиотерапии
перед трансплантацией костного мозга) и до момента
восстановления уровня лейкоцитов в крови (отмена при
лейкоцитах более 1,0 · 109/л). Для профилактики микотической инфекции
использовали флуконазол в дозе 200 мг в сутки,
однократно, перорально или внутривенно, при назначении
антибиотиков дозу увеличивали до 400 мг. Флуконазол
назначали также с первого дня кондиционирования,
исключали при восстановлении уровня лейкоцитов в крови
(> 1,0 ·109/л), отмене всех антибактериальных препаратов.
Показаниями к
назначению антибиотиков (меропенема или цефтазидима с
амикацином) являлись: температура выше 38 °С и наличие
нейтропении - количество лейкоцитов менее 1,0
·109 или высокая вероятность снижения их в течение 48
ч с момента назначения антибиотиков. При рандомизации
больные включались либо в группу монотерапии - препарат
меропенем (меронем) в дозе 2 г каждые 8 ч внутривенно,
или в группу комбинированной терапии - цефтазидим
(фортум) по 2 г каждые 8 ч и амикацин по 500 мг через 8
ч внутривенно.
Рис.
1. Общая длительность лечения инфекционных осложнений
при трансплантации костного мозга.
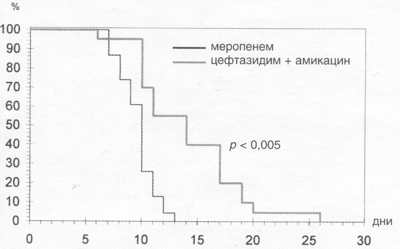
Рис. 2. Длительность лечения инфекционных осложнений при трансплантации аллогенного костного мозга.
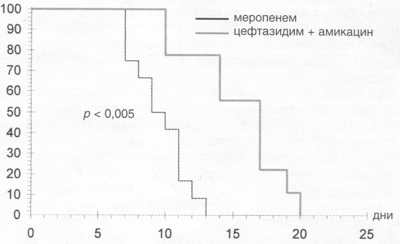
Рис. 3. Длительность лечения инфекционных осложнений при трансплантации аутологичного костного мозга.

Рис. 4. День нормализации температуры при лечении инфекционных осложнений после трансплантации костного мозга.
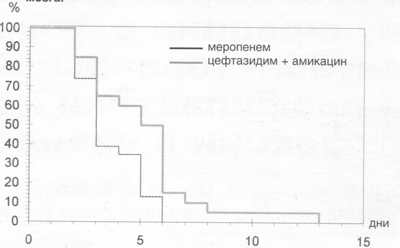
Критериями прекращения
терапии считали: нормальную температуру в течение 5
дней; отсутствие очага инфекции; повышение числа
лейкоцитов более 0,8 · 109/л, подтвержденное двумя анализами крови.
Минимальная длительность лечения составляла не менее 6
дней.
Всем больным
перед включением в протокол исследования, в ходе
выполнения его (через день) и по окончании исследовали
общий и биохимический анализы крови; 2 раза в неделю -
общий анализ мочи. Бактериологические исследования были
следующими: в день назначения антибиотиков - посев крови
из вены и из центрального венозного катетера в
количестве 10 мл, посев мочи, посев со слизистой полости
рта. Микробиологические исследования повторяли при
сохранении, рецидиве лихорадки или выявлении
микроорганизмов в посевах. За 3-7 дней до высокодозной
химиотерапии, перед трансплантацией, а далее в течение
всего времени пребывания больного в стационаре (после
трансплантации) проводили в динамике контрольные посевы
со слизистой полости рта 1 раз в неделю и кала на
дисбактериоз 1 раз в 10-14 дней. Исследования на
дисбактериоз повторяли при возникновении диареи.
Инфекционный процесс
классифицировали как: 1)микробиологически доказанная
инфекция (выявление микроорганизмов из очага инфекции
или крови); 2) клинически доказанная инфекция (наличие
очага инфекции, но микроорганизмы при этом не
обнаружены); 3) лихорадка неясного генеза (наличие
только повышенной температуры без очага инфекции).
Анализ клинической
эффективности антибиотиков проводили через 72 ч после
начала и по окончании лечения, бактериологической - в
конце лечения. Проведенное лечение расценивали как: 1)
излечение без модификаций - регрессия инфекции при
использовании антибиотиков только I этапа; 2) излечение
с модификациями - регрессия инфекции при присоединении
иных препаратов к антибиотикам I этапа (антибиотики I
этапа при этом не отменялись) с указанием препаратов,
добавленных к лечению и времени (дни) их присоединения;
3) общая эффективность - включала излечение без
модификаций и излечение с модификациями; 4) отсутствие
эффекта - смерть больного вследствие инфекционного
осложнения; стойкое сохранение лихорадки или ухудшение,
потребовавшее назначения иных антибактериальных
препаратов (антибиотики I этапа отменялись). Проводился
анализ ранней летальности - это случаи смерти в течение
72 ч с момента назначения антибиотиков.
Статистическую обработку данных
проводили у всех пациентов, включенных в исследование.
Для анализа статистической достоверности использовали
математические методы (t-test). Анализ эффективности
использования антибиотиков во временном промежутке
(time-to-event) оценивали непараметрическим методом,
описанным Kaplan-Мeier и сравнение проводили при помощи
тестов logrank, Mantel-Haenszel и
Wilcoxon-Gehan.
Результаты
и обсуждение
Характеристика больных. За период с
октября 1997 по май 2000 г. проведен анализ
эффективности применения исследуемых антибактериальных
препаратов у больных, находившихся на лечении в
отделении гемобластозов и трансплантации костного мозга
Гематологического научного центра. Лечение меропенемом
проводили в 23 случаях у 22 больных, терапия комбинацией
цефтазидима с амикацином - у 20 пациентов. Анализ
эффективности и токсичности антибактериальных препаратов
проведен во всех случаях. Характеристика больных,
включенных в исследование, представлена в табл. 1. В
целом группы были идентичны по включенным признакам.
Имелись лишь отличия пациентов в распределении по полу:
в группе больных, получавших меропенем, преобладали
женщины (13 женщин, 9 мужчин), а при лечении
цефтазидимом с амикацином - мужчины (13 мужчин, 7
женщин). Кроме одного случая (повторное применение
меропенема), лечение антибиотиками проводилось в период
критической нейтропении. Так, медиана числа лейкоцитов
при назначении меропенема составила 0,2 · 109, цефтазидима с амикацином - 0,3
· 109/л. Хотя группы были идентичны по включенным
признакам, отмечено, что медиана длительности
критической нейтропении была больше при лечении
цефтазидимом с амикацином и это было зафиксировано как в
период лечения антибиотиками (11,5 дней против 8), так и
при анализе общей длительности нейтропении (15,5 дней
против 13 соответственно). Возможно, нейтропения была
индуцирована применением цефтазидима, поскольку данный
симптом отнесен к побочным эффектам, которые могут
возникать при терапии цефалоспоринами.
Показанием к назначению антибиотиков
чаще всего была лихорадка неясного генеза: у 70% больных
при лечении цефтазидимом с амикацином, у 83% - при
терапии меропенемом (табл. 2). Однако у большинства
больных (у 93% при терапии цефтазидимом с амикацином и у
84% - при лечении меропенемом) лихорадка сочеталась с
тяжелым мукозитом, и в некоторых исследованиях данные
проявления относят к клинически доказанной инфекции [2].
При мукозитах практически во всех случаях из полости рта
высевался зеленящий стрептококк. Вероятнее всего, именно
поврежденная слизистая полости рта была входными
воротами для инфекции, возможно, стрептококковой. Тем
более что больные входили в группу риска по развитию
стрептококковой инфекции: имели тяжелый мукозит,
получали фторхинолоны для профилактики.
Тот факт, что поврежденная
слизистая полости рта может быть входными воротами
инфекции, подтверждают исследования по молекулярному
типированию бактерий. ДНК типирование штаммов зеленящего
стрептококка, выделенных из крови больных, а ранее у
этих же больных со слизистой рта, показывает их
идентичность [6].
Частота микробиологически подтвержденной инфекции
составила 10% в группе больных, получавших цефтазидим с
амикацином, и 4% - меропенем. При микробиологическом
исследовании содержимого инфильтрата в области
промежности выявлен Enterococcus spp, посевах мочи - S.epidermidis, крови -
дрожжевые грибы рода кандида в сочетании с S.epidermidis (клинически
сопровождалось температурой до 400С с ознобами). Клинически
доказанная инфекция была представлена пневмониями; в 1
случае, в группе больных, получавших цефтазидим с
амикацином, одновременно в посевах крови выявлена и
кандидемия с первого дня лихорадки.
Клиническая эффективность.
Излечение при использовании только антибиотиков I этапа
- меропенема или цефтазидима с амикацином - составило 65
и 50% соответственно (табл. 3). Никто из больных не умер
в течение первых 72 ч применения препаратов.
Нормализация температуры в течение первых 72 ч
антибактериальной терапии чаще наблюдалась при лечении
меропенемом, чем при использовании комбинации
антибиотиков, и составила 43,5 и 20% соответственно.
Более того, необходимость в дополнительном присоединении
как антибактериальных, так и противогрибковых препаратов
в течение первых 72 ч лечения по протоколу чаще
возникала в группе больных, получавших цефтазидим с
амикацином и зафиксирована у 5 (25%) из 20 больных, в то
время как при лечении меропенемом в 2 (9%) из 23
случаев. В дальнейшем также к комбинации цефтазидима с
амикацином чаще присоединяли антибиотики с большей
активностью в отношении грамположительных бактерий
(ванкомицин, ампициллин/сульбактам) и противогрибковый
препарат амфотерицин В.
Причиной для присоединения
ванкомицина, ампициллина/сульбактама или амфотерицина В
были упорная лихорадка - в 2 случаях при лечении
меропенемом, в 7 - цефтазидимом с амикацином;
повышение температуры на фоне антибактериальной терапии
- в 2 случаях при терапии меропенемом (в 1 -
грамположительная инфекция, в 1 - герпесвирусная
инфекция); рецидив лихорадки - в 4 случаях в группе
больных, получавших меропенем, в 3 - цефтазидим с
амикацином. Ванкомицин был добавлен к меропенему в 5
случаях, однако нормализации температуры удалось достичь
лишь у 2 больных, остальным потребовалось дополнительное
назначение амфотерицина В. В группе пациентов,
получавших цефтазидим с амикацином, эффект от
присоединения ампициллина/сульбактама или ванкомицина
был отмечен лишь у 1 из 7 больных.
Вирусные инфекции (герпетические)
зафиксированы по одному случаю в каждой группе.
Медиана
дополнительного присоединения антибиотиков и
амфотерицина В была несколько отсроченной в группе
больных, получавших меропенем, и составила 5 дней
(диапазон от 2 до 12 дней), в то время как при лечении
цефтазидимом - 4 дня (диапазон от 2 до 13).
Частота добавления
амфотерицина В составила 26% и 45% при
применении меропенема и цефтазидим + амикацин.
Проанализирована
эффективность в зависимости от характера инфекционного
процесса. При лихорадке неясного генеза лечение только
меропенемом было эффективным в 52% случаев (12 из 23),
присоединение ванкомицина в этой группе - в 4,5% (1 из
23), амфотерицина В - в 26% (6 из 23), в группе
сравнения - эффект от терапии цефтазидимом с амикацином
зарегистрирован в 40% (у 8 из 20 больных), присоединение
амфотерицина В было эффективным в 30% (6 из 20). При
микробиологически доказанной инфекции излечение было
достигнуто при добавлении ванкомицина к меропенему; в
группе больных, получавших цефтазидим с амикацином, при
присоединении в одном случае ванкомицина (энтерококковая
инфекция), в другом - амфотерицина В. При
пневмонии (клинически доказанной инфекции) не
потребовалось присоединения других антибиотиков к
меропенему, в то время как при терапии цефтазидимом с
амикацином излечение этими препаратами достигнуто у 2
больных, а 2 пациентам был добавлен амфотерицин В.
Результаты лечения
меропенемом и цефтазидимом с амикацином в зависимости от
вида трансплантации представлены в табл. 4. Наиболее
выраженные отличия выявлены при аллогенной
трансплантации костного мозга. Среди этих пациентов
частота излечения при использовании только антибиотиков I этапа была
выше при терапии меропенемом и составила 75%, в то время
как комбинация цефтазидима с амикацином была успешной у
56% больных. Нормализация температуры в течение первых
72 ч применения меропенема зафиксирована у 67%
больных, в группе сравнения (цефтазидим + амикацин) у
33% пациентов (p=0,14). Необходимость присоединения
амфотерицина В возникала более чем в 2 раза чаще при
лечении цефтазидимом с амикацином, чем меропенемом, и
составила 33% и 17% соответственно.
Получены достоверные отличия
по длительности лечения меропенемом в сравнении с
комбинацией цефтазидима с амикацином (рис. 1). Медиана
общей длительности лечения составила 10 дней (диапазон
от 7 до 13 дней) при терапии меропенемом, 14 дней
(диапазон от 6 до 26 дней) - цефтазидимом с
амикацином; при аллогенной трансплантации костного мозга
- 9,5 дней (диапазон от 7 до 13 дней) и 15,5 дней
(диапазон от 10 до 20 дней) соответственно для каждой из
групп, отличия достоверные (p < 0,005; рис. 2); при
аутологичной трансплантации костного мозга - 8 дней
(диапазон от 8 до 12 дней) и 11 дней (диапазон от 6 до
26 дней), отличия достоверны по одному признаку (p <
0,02; рис. 3).
День нормализации температуры регистрировали раньше при
лечении меропенемом, медиана составила 3 дня (диапазон
от 2 до 6 дней), при терапии цефтазидимом с амикацином -
5 дней с диапазоном от 2 до 13 дней (рис. 4).
Излечение (общая
эффективность) как при использовании только антибиотиков
I этапа, так и с модификациями было зафиксировано
во всех случаях как в группе больных, получавших
меропенем, так и цефтазидим с амикацином.
Во всех случаях
микробиологически доказанной инфекции достигнута
эрадикация микроорганизмов.
Повторное применение антибиотиков
потребовалось у 2 больных, получавших лечение
меропенемом. В 1 случае был рецидив лихорадки неясного
генеза вне периода нейтропении, возникший на 24-й день
после окончания лечения антибиотиками. Повторное
назначение меропенема привело к излечению, длительность
лечения при этом составила 8 дней. У
другого больного рецидив лихорадки возник на 35-й день
после окончания лечения меропенемом и был обусловлен
развитием стоматита на фоне длительной (в течение 108
дней) нейтропении. Назначение метронидазола в сочетании
с ампициллином/сульбактамом было эффективным.
В группе больных,
получавших цефтазидим с амикацином, повторное повышение
температуры зафиксировано у 4 больных: в 2 случаях -
инфекция мочевыводящих путей (на 8 и 21-й дни после
отмены антибиотиков), в 2 - пневмония. Одна больная
погибла.
Токсичность. В группе больных, получавших
меропенем токсические проявления отмечены у 4 (17%) из
23 больных: диарея (1 случай), повышение билирубина (2),
повышение креатинина при терапии амфотерицином В (1).
Повышение уровня билирубина было незначительным, в одном
случае с 9 до 28 мкмоль/л, в другом - с 24 до 41
мкмоль/л, непродолжительным, в дальнейшем отмечено
самостоятельное снижение.
При терапии цефтазидимом с амикацином
частота токсических эффектов была значительно выше, в
большей части проявляемая как сочетанная токсичность, и
составила 60% (у 12 из 20 больных). Проявления были
следующие: повышение уровня креатинина - у 3 больных,
повышение уровня трансаминаз - у 4, гипокалиемия - у 4,
диарея - у 2 (в 1 случае выявлен токсин Cl. difficile), рвота - у 1.
При диарее назначали перорально ванкомицин; повышение
уровня креатинина, гипокалиемия были связаны с введением
амотерицина В (сочетанная токсичность) - в этих случаях
дозу амфотерицина В уменьшали или удлиняли промежутки
между введениями. В одном случае, при стойком повышении
уровня креатинина, был отменен амикацин, во всех
остальных случаях изменения антибактериального лечения
не потребовалось.
Летальность. В ходе проведения лечения
антибиотиками через 1 мес после окончания
антибактериальной терапии - никто из больных не умер.
Через 38 дней и
через 60 дней после окончания лечения антибиотиками
умерло 2 больных в группе, получавших цефтазидим с
амикацином; через 45 дней - 1 больной в группе
пациентов, получавших меропенем. В одном случае причина
смерти - пневмония, вероятнее всего вирусной этиологии
на фоне неконтролируемой болезни "трансплантат
против хозяина"; в другом - желудочно-кишечное
кровотечение также при неконтролируемой болезни
"трансплантат против хозяина", в третьем -
пневмония на фоне неконтролируемой болезни
"трансплантат против хозяина".
Таким образом, в проведенном
исследовании монотерапия меропенемом у наиболее тяжелой
группы больных - реципиентов костного мозга в период
критической нейтропении была эффективной, сопоставимой
по результатам излечения с комбинацией двумя
антибиотиками - цефтазидимом с амикацином и составила 65
и 50% соответственно. Длительность лечения меропенемом
была меньше в сравнении с комбинацией цефтазидима с
амикацином, отличия достоверные.
Необходимо отметить, что при терапии
меропенемом реже возникала необходимость присоединения
ванкомицина, и это объясняется как более широким
спектром антимикробной активности препарата, так и
меньшей частотой развития резистентности к нему бактерий
[1]. Необходимость в присоединении амфотерицина В также
чаще возникала у больных, получавших лечение
цефтазидимом с амикацином, и была обусловлена большим
числом антибиотиков, используемых в этой группе.
Токсичность при
лечении меропенемом была значительно ниже, чем при
лечении двумя антибиотиками. В большинстве случаев
токсические проявления при терапии цефтазидимом с
амикацином носили характер сочетанной
токсичности.
Литература
1.
Hurst M, Lamb H. Meropenem Drugs. 2000; 59
(3):653-80.
2.
Cometta A, Glauser M. Empiric
antibiotic monotherapy carbapenems in febrile
neutropenia: a review. J Chemother 1996; 8: 375-81.
3. Meropenem study
group of Leuven, London and Nijmegen et al. Equivalent
efficacies of meropenem and ceftazidime as empirical
monotherapy of
febrile neutropenic patients J Аntimicrob Chemother
1995; 36:185-200.
4. Cometta A,Calandra T, Gaya H. et al. Monotherapy with
meropenem versus combination therapy with ceftazidime
plus amikacin as empiric therapy for fever in
granulocytopenic patients with cancer.
Antimicrob Agents Chemother 1996; 1108-15.
5. Vandercam B, Gerain
J, Humblet Y, et al. Meropenem versus ceftazidime as
empirical monotherapy for febrile neutropenic cancer
patients. Ann Hemat 2000; 79 (3): 152-157.
6. Carratala J, Gudiol
F. Changing epidemiology of bacterial infection in
neutropenic patients with cancer. In book: Supportive
Care in Cancer Patients; Ed. M.Karthaus, A.Ganser.
Karger, 2000; 1-10.
Сравнительная эффективность монотерапии меропенемом и комбинации цефтазидима с амикацином в режиме эмпирической терапии при трансплантации костного мозга
Г.А. Клясова, В.Г. Савченко, Л.С. Любимова, Л.П. Менделеева, Е.Н. Паровичникова, Т.В. Толкачева, Н.А. Петрова, Б.В. Зингерман, Ю.Ю. Гудилина
Гематологический научный центр, Москва
Современная высокодозная химиотерапия сопряжена с высоким риском развития инфекционных осложнений, течение которых может быть фатальным, если эмпирическая антибактериальная терапия в период критической нейтропении не начата вовремя, при первых же признаках инфекции. В этих случаях назначают антибиотики широкого спектра действия и наиболее часто используемой комбинацией является сочетание цефалоспоринов III поколения с аминогликозидами. Такая комбинация антибиотиков характеризуется синергидным действием в отношении грамотрицательных микробов и меньшей вероятностью появления резистентности. Однако применение аминогликозид - содержащих режимов не лишено недостатков. Отрицательной стороной использования комбинации аминогликозидов с бета-лактамами является большая частота развития токсических эффектов (гипокалиемия, поражение почек, печени), необходимость проведения мониторинга концентраций аминогликозидов в крови, и, что крайне важно, имеется высокий риск развития сочетанной токсичности, особенно при использовании средств с аналогичным побочным действием, например, амфотерицина В, циклоспорина А, ацикловира, ванкомицина, назначение которых не является редкостью, особенно при трансплантации костного мозга. Вероятность развития токсических осложнений и нежелательных взаимодействий между используемыми препаратами может быть снижена при лечении инфекций одним антибиотиком, обладающим большей активностью в отношении грамотрицательных бактерий, в том числе синегнойной палочки, а также и в отношении грамположительных бактерий. В этиологической структуре инфекционных осложнений нейтропении на долю грамположительных бактерий в настоящее время приходится 60-70%. Этим требованиям отвечают карбапенемы - имипенем/циластатин и меропенем - антибиотики с наиболее широким спектром антибактериальной активности [1, 2]. При назначении этих препаратов уменьшается необходимость в дополнительном присоединении иных антибактериальных средств.Таблица 1. Характеристика больных, включенных в исследование
|
Характеристика |
Меропенем |
Цефтазидим + Амикацин |
| Число больных |
22 |
20 |
| Число случаев |
23 |
20 |
| Возраст, медиана (диапазон) |
31 (16-43) |
36 (15-50) |
| Пол: мужчины |
9 |
13 |
| женщины |
13 |
7 |
| Нозологическая форма заболевания: | ||
| хронический миелолейкоз |
13 |
12 |
| лимфогранулематоз | 5 |
2 |
| острый миелоидный лейкоз |
3 |
3 |
| острый лимфоидный лейкоз | - |
1 |
| лимфосаркома |
1 |
1 |
| рак молочной железы | - |
1 |
| Аутологичная трансплантация | ||
| костного мозга/стволовых клеток крови |
11 (2/9) |
11 (4/7) |
| Аллогенная трансплантация костного мозга |
12 |
9 |
| Нейтропения (лейкоцитов < 1 . 109/л) |
22/23 |
20/20 |
| Длительность нейтропении в целом, медиана (диапазон) |
13 (6-108) |
15,5 (7-41) |
| Длительность нейтропении при лечении антибиотиками, медиана (диапазон) |
8 (5-13) |
11,5 (3-26) |
| Число лейкоцитов при назначении антибиотиков |
0,2 (0,1-1,1) |
0,3 (0,1-3,5) |
| Число лейкоцитов при окончании лечения антибиотиками |
1,3 (0,7-6,3) |
1,3 (0,8-2,6) |
| Селективная деконтаминация кишечника: |
21/23 |
20/20 |
| Ципрофлоксацин |
19/21 |
17/20 |
| Триметоприм/сульфаметоксазол |
1/21 |
2/20 |
| Полимиксин В |
1/21 |
- |
| Офлоксацин |
- |
1/20 |
| Противогрибковая профилактика: |
23/23 |
19/20 |
| Флуконазол |
23 |
20 |
| Амфотерицин В |
- |
1 |
| Противовирусная профилактика: |
3/23 |
2/20 |
| Ацикловир |
3 |
2 |
| Центральный венозный катетер |
23 |
20 |
Таблица 2. Основания для назначения антибиотиков
| Показатель | Меропенем | Цефтазидим + Амикацин |
| Лихорадка неясного генеза |
19 (83%) |
14 (70%) |
| Стоматит |
14 (61%) |
11 (55%) |
| Стоматит+ некротическая энтеропатия |
2 (9%) |
2 (10%) |
| Микробиологически доказанная инфекция |
1 (4%) |
2 (10%) |
| Инфильтрат в области промежности |
- |
1 |
| Инфекция мочевыводящих путей |
- |
1 |
| Бактериемия |
1 |
- |
| Клинически доказанная инфекция (пневмония) |
3 (13%) |
4 (20%) |
Таблица 3. Результаты лечения
|
Показатель |
Меропенем |
Цефтазидим + Амикацин |
| Излечение (антибиотики I этапа) |
15/23 (65%) |
10/20 (50%) |
| Нормализация температуры через 72 ч |
10/23 (43,5%) |
4/20 (20%) |
| Модификация лечения в течение первых 72 ч |
2/23 (9%) |
5/20 (25%) |
| Излечение с модификациями |
8/23 (35%) |
10/20 (50%) |
| + ванкомицин |
5/23 (22%) |
4/20 (20%) |
| +ампициллин/сульбактам |
- |
3/20 (15%) |
| из них с эффектом |
2/5* |
1/7* |
| +амфотерицин В |
6/23 (26%) |
9/20 (45%) |
| Повторное назначение антибиотиков |
2/23 (9%) |
4/20 (20%) |
| Дни** |
24, 35 |
8, 15, 21, 32 |
|
* В остальных случаях
потребовалось присоединение амфотерицина В. ** С момента окончания лечения. | ||
Таблица 4. Результаты лечения в зависимости от вида трансплантации костного мозга
|
Показатель |
Меропенем |
Цефтазидим + Амикацин |
| Аутологичная |
n=11 |
n=11 |
| Излечение (антибиотики I этапа) |
6/11 (55%) |
5/11 (45%) |
| Нормализация температуры через 72 ч |
2/11 (18%) |
1/11 (9%) |
| Излечение с модификациями |
5/11 (45%) |
6/11 (55%) |
| + ванкомицин |
3/11 (27%) |
4/11 (36%) |
| из них с эффектом |
1/3 |
1/4 |
| +амфотерицин В |
4/11 (36%) |
5/11 (45%) |
| Повторное назначение антибиотиков |
1/11 (9%) |
1/11 (9%) |
| Аллогенная |
n=12 |
n=9 |
| Излечение (антибиотики I этапа) |
9/12 (75%) |
5/9 (56%) |
| Нормализация температуры через 72 ч |
8/12 (67%) |
3/9 (33%) |
| Излечение с модификациями |
3/12 (25%) |
4/9 (44%) |
| + ванкомицин |
2/12 (25%) |
3/9 (33%) |
| из них с эффектом |
1/2 |
0/3 |
| +амфотерицин В |
2/12 (17%) |
4/9 (44%) |
| Повторное назначение антибиотиков |
1/12 (8%) |
3/9 (33%) |
Эффективность меропенема в режиме монотерапии, изученная в большом числе контролируемых исследований, составляет 48-56% [2-5]. Однако эти исследования практически не охватывали или включали ограниченное (до 15%) число больных после трансплантации костного мозга [5]. Цель настоящего рандомизированного исследования - оценить эффективность применения меропенема в сравнении с комбинацией цефтазидима и амикацина у наиболее тяжелой группы пациентов - после трансплантации аллогенного и аутологичного костного мозга.
Материалы и
методы
В
исследование включены пациенты, которым была проведена
трансплантация аллогенного или аутологичного костного
мозга (или стволовых клеток крови).
Всем больным проводили селективную
деконтаминацию кишечника, в основном ципрофлоксацином,
по 250 мг 2 раза в день, перорально, с первого дня
режима кондиционирования (высокодозной химиотерапии
перед трансплантацией костного мозга) и до момента
восстановления уровня лейкоцитов в крови (отмена при
лейкоцитах более 1,0 · 109/л). Для профилактики микотической инфекции
использовали флуконазол в дозе 200 мг в сутки,
однократно, перорально или внутривенно, при назначении
антибиотиков дозу увеличивали до 400 мг. Флуконазол
назначали также с первого дня кондиционирования,
исключали при восстановлении уровня лейкоцитов в крови
(> 1,0 ·109/л), отмене всех антибактериальных препаратов.
Показаниями к
назначению антибиотиков (меропенема или цефтазидима с
амикацином) являлись: температура выше 38 °С и наличие
нейтропении - количество лейкоцитов менее 1,0
·109 или высокая вероятность снижения их в течение 48
ч с момента назначения антибиотиков. При рандомизации
больные включались либо в группу монотерапии - препарат
меропенем (меронем) в дозе 2 г каждые 8 ч внутривенно,
или в группу комбинированной терапии - цефтазидим
(фортум) по 2 г каждые 8 ч и амикацин по 500 мг через 8
ч внутривенно.
Рис.
1. Общая длительность лечения инфекционных осложнений
при трансплантации костного мозга.

Рис. 2. Длительность лечения инфекционных осложнений при трансплантации аллогенного костного мозга.

Рис. 3. Длительность лечения инфекционных осложнений при трансплантации аутологичного костного мозга.

Рис. 4. День нормализации температуры при лечении инфекционных осложнений после трансплантации костного мозга.

Критериями прекращения
терапии считали: нормальную температуру в течение 5
дней; отсутствие очага инфекции; повышение числа
лейкоцитов более 0,8 · 109/л, подтвержденное двумя анализами крови.
Минимальная длительность лечения составляла не менее 6
дней.
Всем больным
перед включением в протокол исследования, в ходе
выполнения его (через день) и по окончании исследовали
общий и биохимический анализы крови; 2 раза в неделю -
общий анализ мочи. Бактериологические исследования были
следующими: в день назначения антибиотиков - посев крови
из вены и из центрального венозного катетера в
количестве 10 мл, посев мочи, посев со слизистой полости
рта. Микробиологические исследования повторяли при
сохранении, рецидиве лихорадки или выявлении
микроорганизмов в посевах. За 3-7 дней до высокодозной
химиотерапии, перед трансплантацией, а далее в течение
всего времени пребывания больного в стационаре (после
трансплантации) проводили в динамике контрольные посевы
со слизистой полости рта 1 раз в неделю и кала на
дисбактериоз 1 раз в 10-14 дней. Исследования на
дисбактериоз повторяли при возникновении диареи.
Инфекционный процесс
классифицировали как: 1)микробиологически доказанная
инфекция (выявление микроорганизмов из очага инфекции
или крови); 2) клинически доказанная инфекция (наличие
очага инфекции, но микроорганизмы при этом не
обнаружены); 3) лихорадка неясного генеза (наличие
только повышенной температуры без очага инфекции).
Анализ клинической
эффективности антибиотиков проводили через 72 ч после
начала и по окончании лечения, бактериологической - в
конце лечения. Проведенное лечение расценивали как: 1)
излечение без модификаций - регрессия инфекции при
использовании антибиотиков только I этапа; 2) излечение
с модификациями - регрессия инфекции при присоединении
иных препаратов к антибиотикам I этапа (антибиотики I
этапа при этом не отменялись) с указанием препаратов,
добавленных к лечению и времени (дни) их присоединения;
3) общая эффективность - включала излечение без
модификаций и излечение с модификациями; 4) отсутствие
эффекта - смерть больного вследствие инфекционного
осложнения; стойкое сохранение лихорадки или ухудшение,
потребовавшее назначения иных антибактериальных
препаратов (антибиотики I этапа отменялись). Проводился
анализ ранней летальности - это случаи смерти в течение
72 ч с момента назначения антибиотиков.
Статистическую обработку данных
проводили у всех пациентов, включенных в исследование.
Для анализа статистической достоверности использовали
математические методы (t-test). Анализ эффективности
использования антибиотиков во временном промежутке
(time-to-event) оценивали непараметрическим методом,
описанным Kaplan-Мeier и сравнение проводили при помощи
тестов logrank, Mantel-Haenszel и
Wilcoxon-Gehan.
Результаты
и обсуждение
Характеристика больных. За период с
октября 1997 по май 2000 г. проведен анализ
эффективности применения исследуемых антибактериальных
препаратов у больных, находившихся на лечении в
отделении гемобластозов и трансплантации костного мозга
Гематологического научного центра. Лечение меропенемом
проводили в 23 случаях у 22 больных, терапия комбинацией
цефтазидима с амикацином - у 20 пациентов. Анализ
эффективности и токсичности антибактериальных препаратов
проведен во всех случаях. Характеристика больных,
включенных в исследование, представлена в табл. 1. В
целом группы были идентичны по включенным признакам.
Имелись лишь отличия пациентов в распределении по полу:
в группе больных, получавших меропенем, преобладали
женщины (13 женщин, 9 мужчин), а при лечении
цефтазидимом с амикацином - мужчины (13 мужчин, 7
женщин). Кроме одного случая (повторное применение
меропенема), лечение антибиотиками проводилось в период
критической нейтропении. Так, медиана числа лейкоцитов
при назначении меропенема составила 0,2 · 109, цефтазидима с амикацином - 0,3
· 109/л. Хотя группы были идентичны по включенным
признакам, отмечено, что медиана длительности
критической нейтропении была больше при лечении
цефтазидимом с амикацином и это было зафиксировано как в
период лечения антибиотиками (11,5 дней против 8), так и
при анализе общей длительности нейтропении (15,5 дней
против 13 соответственно). Возможно, нейтропения была
индуцирована применением цефтазидима, поскольку данный
симптом отнесен к побочным эффектам, которые могут
возникать при терапии цефалоспоринами.
Показанием к назначению антибиотиков
чаще всего была лихорадка неясного генеза: у 70% больных
при лечении цефтазидимом с амикацином, у 83% - при
терапии меропенемом (табл. 2). Однако у большинства
больных (у 93% при терапии цефтазидимом с амикацином и у
84% - при лечении меропенемом) лихорадка сочеталась с
тяжелым мукозитом, и в некоторых исследованиях данные
проявления относят к клинически доказанной инфекции [2].
При мукозитах практически во всех случаях из полости рта
высевался зеленящий стрептококк. Вероятнее всего, именно
поврежденная слизистая полости рта была входными
воротами для инфекции, возможно, стрептококковой. Тем
более что больные входили в группу риска по развитию
стрептококковой инфекции: имели тяжелый мукозит,
получали фторхинолоны для профилактики.
Тот факт, что поврежденная
слизистая полости рта может быть входными воротами
инфекции, подтверждают исследования по молекулярному
типированию бактерий. ДНК типирование штаммов зеленящего
стрептококка, выделенных из крови больных, а ранее у
этих же больных со слизистой рта, показывает их
идентичность [6].
Частота микробиологически подтвержденной инфекции
составила 10% в группе больных, получавших цефтазидим с
амикацином, и 4% - меропенем. При микробиологическом
исследовании содержимого инфильтрата в области
промежности выявлен Enterococcus spp, посевах мочи - S.epidermidis, крови -
дрожжевые грибы рода кандида в сочетании с S.epidermidis (клинически
сопровождалось температурой до 400С с ознобами). Клинически
доказанная инфекция была представлена пневмониями; в 1
случае, в группе больных, получавших цефтазидим с
амикацином, одновременно в посевах крови выявлена и
кандидемия с первого дня лихорадки.
Клиническая эффективность.
Излечение при использовании только антибиотиков I этапа
- меропенема или цефтазидима с амикацином - составило 65
и 50% соответственно (табл. 3). Никто из больных не умер
в течение первых 72 ч применения препаратов.
Нормализация температуры в течение первых 72 ч
антибактериальной терапии чаще наблюдалась при лечении
меропенемом, чем при использовании комбинации
антибиотиков, и составила 43,5 и 20% соответственно.
Более того, необходимость в дополнительном присоединении
как антибактериальных, так и противогрибковых препаратов
в течение первых 72 ч лечения по протоколу чаще
возникала в группе больных, получавших цефтазидим с
амикацином и зафиксирована у 5 (25%) из 20 больных, в то
время как при лечении меропенемом в 2 (9%) из 23
случаев. В дальнейшем также к комбинации цефтазидима с
амикацином чаще присоединяли антибиотики с большей
активностью в отношении грамположительных бактерий
(ванкомицин, ампициллин/сульбактам) и противогрибковый
препарат амфотерицин В.
Причиной для присоединения
ванкомицина, ампициллина/сульбактама или амфотерицина В
были упорная лихорадка - в 2 случаях при лечении
меропенемом, в 7 - цефтазидимом с амикацином;
повышение температуры на фоне антибактериальной терапии
- в 2 случаях при терапии меропенемом (в 1 -
грамположительная инфекция, в 1 - герпесвирусная
инфекция); рецидив лихорадки - в 4 случаях в группе
больных, получавших меропенем, в 3 - цефтазидим с
амикацином. Ванкомицин был добавлен к меропенему в 5
случаях, однако нормализации температуры удалось достичь
лишь у 2 больных, остальным потребовалось дополнительное
назначение амфотерицина В. В группе пациентов,
получавших цефтазидим с амикацином, эффект от
присоединения ампициллина/сульбактама или ванкомицина
был отмечен лишь у 1 из 7 больных.
Вирусные инфекции (герпетические)
зафиксированы по одному случаю в каждой группе.
Медиана
дополнительного присоединения антибиотиков и
амфотерицина В была несколько отсроченной в группе
больных, получавших меропенем, и составила 5 дней
(диапазон от 2 до 12 дней), в то время как при лечении
цефтазидимом - 4 дня (диапазон от 2 до 13).
Частота добавления
амфотерицина В составила 26% и 45% при
применении меропенема и цефтазидим + амикацин.
Проанализирована
эффективность в зависимости от характера инфекционного
процесса. При лихорадке неясного генеза лечение только
меропенемом было эффективным в 52% случаев (12 из 23),
присоединение ванкомицина в этой группе - в 4,5% (1 из
23), амфотерицина В - в 26% (6 из 23), в группе
сравнения - эффект от терапии цефтазидимом с амикацином
зарегистрирован в 40% (у 8 из 20 больных), присоединение
амфотерицина В было эффективным в 30% (6 из 20). При
микробиологически доказанной инфекции излечение было
достигнуто при добавлении ванкомицина к меропенему; в
группе больных, получавших цефтазидим с амикацином, при
присоединении в одном случае ванкомицина (энтерококковая
инфекция), в другом - амфотерицина В. При
пневмонии (клинически доказанной инфекции) не
потребовалось присоединения других антибиотиков к
меропенему, в то время как при терапии цефтазидимом с
амикацином излечение этими препаратами достигнуто у 2
больных, а 2 пациентам был добавлен амфотерицин В.
Результаты лечения
меропенемом и цефтазидимом с амикацином в зависимости от
вида трансплантации представлены в табл. 4. Наиболее
выраженные отличия выявлены при аллогенной
трансплантации костного мозга. Среди этих пациентов
частота излечения при использовании только антибиотиков I этапа была
выше при терапии меропенемом и составила 75%, в то время
как комбинация цефтазидима с амикацином была успешной у
56% больных. Нормализация температуры в течение первых
72 ч применения меропенема зафиксирована у 67%
больных, в группе сравнения (цефтазидим + амикацин) у
33% пациентов (p=0,14). Необходимость присоединения
амфотерицина В возникала более чем в 2 раза чаще при
лечении цефтазидимом с амикацином, чем меропенемом, и
составила 33% и 17% соответственно.
Получены достоверные отличия
по длительности лечения меропенемом в сравнении с
комбинацией цефтазидима с амикацином (рис. 1). Медиана
общей длительности лечения составила 10 дней (диапазон
от 7 до 13 дней) при терапии меропенемом, 14 дней
(диапазон от 6 до 26 дней) - цефтазидимом с
амикацином; при аллогенной трансплантации костного мозга
- 9,5 дней (диапазон от 7 до 13 дней) и 15,5 дней
(диапазон от 10 до 20 дней) соответственно для каждой из
групп, отличия достоверные (p < 0,005; рис. 2); при
аутологичной трансплантации костного мозга - 8 дней
(диапазон от 8 до 12 дней) и 11 дней (диапазон от 6 до
26 дней), отличия достоверны по одному признаку (p <
0,02; рис. 3).
День нормализации температуры регистрировали раньше при
лечении меропенемом, медиана составила 3 дня (диапазон
от 2 до 6 дней), при терапии цефтазидимом с амикацином -
5 дней с диапазоном от 2 до 13 дней (рис. 4).
Излечение (общая
эффективность) как при использовании только антибиотиков
I этапа, так и с модификациями было зафиксировано
во всех случаях как в группе больных, получавших
меропенем, так и цефтазидим с амикацином.
Во всех случаях
микробиологически доказанной инфекции достигнута
эрадикация микроорганизмов.
Повторное применение антибиотиков
потребовалось у 2 больных, получавших лечение
меропенемом. В 1 случае был рецидив лихорадки неясного
генеза вне периода нейтропении, возникший на 24-й день
после окончания лечения антибиотиками. Повторное
назначение меропенема привело к излечению, длительность
лечения при этом составила 8 дней. У
другого больного рецидив лихорадки возник на 35-й день
после окончания лечения меропенемом и был обусловлен
развитием стоматита на фоне длительной (в течение 108
дней) нейтропении. Назначение метронидазола в сочетании
с ампициллином/сульбактамом было эффективным.
В группе больных,
получавших цефтазидим с амикацином, повторное повышение
температуры зафиксировано у 4 больных: в 2 случаях -
инфекция мочевыводящих путей (на 8 и 21-й дни после
отмены антибиотиков), в 2 - пневмония. Одна больная
погибла.
Токсичность. В группе больных, получавших
меропенем токсические проявления отмечены у 4 (17%) из
23 больных: диарея (1 случай), повышение билирубина (2),
повышение креатинина при терапии амфотерицином В (1).
Повышение уровня билирубина было незначительным, в одном
случае с 9 до 28 мкмоль/л, в другом - с 24 до 41
мкмоль/л, непродолжительным, в дальнейшем отмечено
самостоятельное снижение.
При терапии цефтазидимом с амикацином
частота токсических эффектов была значительно выше, в
большей части проявляемая как сочетанная токсичность, и
составила 60% (у 12 из 20 больных). Проявления были
следующие: повышение уровня креатинина - у 3 больных,
повышение уровня трансаминаз - у 4, гипокалиемия - у 4,
диарея - у 2 (в 1 случае выявлен токсин Cl. difficile), рвота - у 1.
При диарее назначали перорально ванкомицин; повышение
уровня креатинина, гипокалиемия были связаны с введением
амотерицина В (сочетанная токсичность) - в этих случаях
дозу амфотерицина В уменьшали или удлиняли промежутки
между введениями. В одном случае, при стойком повышении
уровня креатинина, был отменен амикацин, во всех
остальных случаях изменения антибактериального лечения
не потребовалось.
Летальность. В ходе проведения лечения
антибиотиками через 1 мес после окончания
антибактериальной терапии - никто из больных не умер.
Через 38 дней и
через 60 дней после окончания лечения антибиотиками
умерло 2 больных в группе, получавших цефтазидим с
амикацином; через 45 дней - 1 больной в группе
пациентов, получавших меропенем. В одном случае причина
смерти - пневмония, вероятнее всего вирусной этиологии
на фоне неконтролируемой болезни "трансплантат
против хозяина"; в другом - желудочно-кишечное
кровотечение также при неконтролируемой болезни
"трансплантат против хозяина", в третьем -
пневмония на фоне неконтролируемой болезни
"трансплантат против хозяина".
Таким образом, в проведенном
исследовании монотерапия меропенемом у наиболее тяжелой
группы больных - реципиентов костного мозга в период
критической нейтропении была эффективной, сопоставимой
по результатам излечения с комбинацией двумя
антибиотиками - цефтазидимом с амикацином и составила 65
и 50% соответственно. Длительность лечения меропенемом
была меньше в сравнении с комбинацией цефтазидима с
амикацином, отличия достоверные.
Необходимо отметить, что при терапии
меропенемом реже возникала необходимость присоединения
ванкомицина, и это объясняется как более широким
спектром антимикробной активности препарата, так и
меньшей частотой развития резистентности к нему бактерий
[1]. Необходимость в присоединении амфотерицина В также
чаще возникала у больных, получавших лечение
цефтазидимом с амикацином, и была обусловлена большим
числом антибиотиков, используемых в этой группе.
Токсичность при
лечении меропенемом была значительно ниже, чем при
лечении двумя антибиотиками. В большинстве случаев
токсические проявления при терапии цефтазидимом с
амикацином носили характер сочетанной
токсичности.
Литература
1.
Hurst M, Lamb H. Meropenem Drugs. 2000; 59
(3):653-80.
2.
Cometta A, Glauser M. Empiric
antibiotic monotherapy carbapenems in febrile
neutropenia: a review. J Chemother 1996; 8: 375-81.
3. Meropenem study
group of Leuven, London and Nijmegen et al. Equivalent
efficacies of meropenem and ceftazidime as empirical
monotherapy of
febrile neutropenic patients J Аntimicrob Chemother
1995; 36:185-200.
4. Cometta A,Calandra T, Gaya H. et al. Monotherapy with
meropenem versus combination therapy with ceftazidime
plus amikacin as empiric therapy for fever in
granulocytopenic patients with cancer.
Antimicrob Agents Chemother 1996; 1108-15.
5. Vandercam B, Gerain
J, Humblet Y, et al. Meropenem versus ceftazidime as
empirical monotherapy for febrile neutropenic cancer
patients. Ann Hemat 2000; 79 (3): 152-157.
6. Carratala J, Gudiol
F. Changing epidemiology of bacterial infection in
neutropenic patients with cancer. In book: Supportive
Care in Cancer Patients; Ed. M.Karthaus, A.Ganser.
Karger, 2000; 1-10.
