Спинальная анестезия с точки зрения адекватности защиты организма от операционной травмы.
Спинальная анестезия с точки зрения адекватности защиты организма от операционной травмы.
А.М.Овечкин, А.В.Гнездилов, М.Л.Кукушкин, А.В.Сыровегин, Д.В.Морозов, В.А.Торшин, Е.Ю.Хмелькова.
Отдел анестезиологии и интенсивной терапии Центрального НИИ протезирования, Москва.
URL
Степень защиты организма от операционной травмы при помощи различных методов анестезии, равно как и критерии ее адекватности, в настоящее время продолжают оставаться предметом дискуссий. Известно, что тканевое повреждение индуцирует целый каскад патофизиологических процессов, затрагивающих всю ноцицептивную систему, от периферических рецепторов до корковых нейронов. Основными звеньями данной цепи являются: а) выделение алгогенов в зоне повреждения (брадикинин, лейкотриены, субстанция Р, простагландины и др.) с сенситизацией периферических ноцицепторов, б) мощная повреждающая стимуляция ноцицептивных структур на различных уровнях ЦНС, в) сенситизация сегментарных и супрасегментарных структур ЦНС с изменением их функциональной активности. На протяжении двух последних десятилетий были получены доказательства изменений реактивности ноцицептивных нейронов задних рогов спинного мозга (ЗРСМ), индуцированных периферическими повреждающими импульсами [17,19]. Результатом является формирование стойкой гипервозбудимости ноцицептивных нейронов ЗРСМ [24], которое имеет двухфазный характер, причем активность связанная с поздней фазой зависит от спинальных изменений, генерированных в процессе ранней фазы, непосредственно при нанесении болевого импульса [14]. Сенситизация нейронов ЗРСМ приводит к увеличению их спонтанной активности, снижению болевых порогов (гипералгезия) и расширению рецептивных полей [23,13]. Для развития гипералгезии критично, чтобы первичные повреждающие импульсы из раны достигли сегментарных структур ЦНС.
Клиническим результатом неадекватной защиты ЦНС от операционной травмы является формирование интенсивного послеоперационного болевого синдрома, который, при определенных условиях, трансформируется в хронический болевой синдром [15,7].
Сформировавшиеся в последние годы представления о механизмах повреждающего действия хирургической травмы на структуры центральной нервной системы, создали предпосылки для проведения данного исследования, задачей которого явилось изучение возможностей предупреждения вышеуказанных патологических изменений функциональной активности ЦНС при помощи методов регионарной анестезии.
Материал и методы. Исследования были выполнены у 554 больных, оперированных в плановом порядке, преимущественно, по поводу патологии опорно-двигательного аппарата, а также заболеваний органов малого таза. Средний возраст пациентов составлял 52± 7,8 лет, среди них было 398 мужчин и 156 женщин. Все пациенты были разделены на 3 группы в зависимости от метода анестезии, применявшегося во время операции. Пациенты 1-й группы (n=203) были оперированы в условиях одномоментной эпидуральной анестезии (ЭА), 2-й (n=182) – в условиях спинальной анестезии (СА), в 3-й группе (n=169) во время операции проводилась общая анестезия (ОА).
У пациентов 1-й группы эпидуральное пространство пунктировали по стандартной методике при помощи набора “Minipack-1" ("SIMS Portex") на уровне L2-3. После верификации эпидурального пространства вводили тест-дозу 50 мг 2% лидокаина, а спустя 5 минут – основную расчетную дозу вышеуказанного препарата. При выполнении СА во 2-й группе пункцию осуществляли на уровне L3-4 иглой типа Pencil Point 25G, проводя ее через просвет иглы-направителя, предварительно введенной в соответствующий межпозвонковый промежуток. После верификации субарахноидального пространства (появления ликвора в павильоне спинальной иглы) медленно вводили 4 мл 0,5% спинального маркаина. В 3-й группе проводили сбалансированную многокомпонентную анестезию с использованием закиси азота и препаратов для нейролептанальгезии.
Адекватность анестезии во время операции оценивали при помощи общепринятых клинических тестов. При этом пациенты, у которых по тем или иным причинам анестезия была признана неадекватной, исключались из исследования. В послеоперационном периоде все пациенты, включенные в исследование, в течение 2-х суток находились в блоке интенсивной терапии. Обезболивание проводили внутривенным болюсным введением морфина (болюс 2 мг) в режиме «по требованию пациента».
Исследование имело 2-х этапный характер. На первом этапе клинически оценивали развитие послеоперационного болевого синдрома на основании показателей, признанных Международной Ассоциацией по изучению боли в качестве критериев, отражающих его динамику. Такими критериями являлись: а) время первого требования анальгетика, т.е. длительность безболевого периода после окончания операции, б) средняя интенсивность боли по 10-бальной визуально-аналоговой шкале (ВАШ) в течении 48 часов после операции, в) средний расход морфина на протяжении 48 часов после операции, г) процент пациентов, не нуждавшихся в послеоперационном обезболивании.
На втором этапе оценивали функциональное состояние нейронов ЗРСМ у пациентов, оперированных с применением различных методов анестезии. Для тестирования активности ноцицептивных нейронов использовали методику регистрации Н-рефлекса. Несмотря на то, что возникновение Н-рефлекса не обусловлено непосредственным раздражением ноцицептивных афферентов, считают, что его амплитуда значительно увеличивается при активации ноцицептивных нейронов задних рогов спинного мозга повреждающими импульсами [4,12]. Н-рефлекс регистрировали как ответ на монополярное электрическое раздражение n.tibialis и n.peroneus в подколенной ямке через поверхностные электроды прямоугольными импульсами тока длительностью 0,2 мс и интервалом 15 секунд. В каждом исследовании первоначально определяли максимальную амплитуду Н-рефлекса, после чего записывали контрольные Н-рефлексы с камбаловидной (КМ) и передней большеберцовой мышц (ПБМ), составляющие, соответственно, 30 и 10% от максимальной величины. Далее регистрировали тестирующие Н-рефлексы такой величины в паре с ноцицептивным флексорным рефлексом (RIII), но с задержками от 0 до 300 мс после вызова кондиционирующего RIII-рефлекса КМ и ПБМ при болевом электрическом раздражении фаланг 1-го и 2-го пальцев стопы одиночными прямоугольными импульсами силой 35-40 мА. Регистрацию мышечных ответов осуществляли с помощью поверхностных электродов, накладываемых биполярно на КМ и ПБМ. Электромиографические сигналы усиливали в полосе пропускания частот 20-2000 Гц на электрофизиологической системе TIESY и регистрировали с частотой опроса 5 кГц, используя IBM PC (80386).
Анализ изменения амплитуды тестирующего Н-рефлекса, вызываемого в паре с кондиционирующим RIII-рефлексом, проводили по отношению к амплитуде контрольного Н-рефлекса после усреднения по 10 предъявлениям. Первичную регистрацию Н-рефлекса осуществляли за 24 часа до хирургического вмешательства, изменения амплитуды Н-рефлекса по отношению к исходной оценивали спустя 48 часов после операции.
Статистическую обработку полученных данных проводили с использованием методов параметрического и непараметрического анализа.
Результаты исследований и их обсуждение. Основные показатели, отражающие динамику послеоперационного болевого синдрома, представлены в Таблице 1.
Таблица 1. Оценка интенсивности послеоперационного болевого синдрома при различных методах анестезии во время операции.
|
Критерии интенсивности послеоперационной боли |
группа 1 ЭА (n=203) |
группа 2 СА (n=182) |
Группа 3 ОА (n=169) |
|
Время 1-го требования анальгетика (час) |
2,1± 0,8 |
6,9± 1,5** |
1,3± 0,1 |
|
Средняя интенсивность послеоперационной боли (баллы) |
3,7± 1,1 |
1,8± 0,4* |
4,8 ± 1,9 |
|
Средняя суммарная доза морфина за 48 часов (мг) |
16,2± 3,3* |
7,1± 0,4** |
28,1± 5,7 |
|
Процент пациентов, не нуждавшихся в послеоперационном обезболивании |
6,4 |
20,9 |
- |
* - р<0,05
** - p<0,01
Анализ развития послеоперационного болевого синдрома выявил наличие достаточно длительного безболевого периода у пациентов 2-й группы, оперированных в условиях спинальной анестезии (6,9± 1,5 часа), существенно превышавшего по продолжительности как аналогичный показатель в 1-3-й группах, так и среднюю продолжительность фармакологического действия маркаина. Этот момент является очень важным, так как установлено, что среднесуточная интенсивность боли, а также вероятность хронизации болевого синдрома прямо пропорционально зависят от наличия и интенсивности болевых ощущений на протяжении первых 5 часов после окончания операции [8,22]. Средняя интенсивность боли в группе 2 (1,8± 0,4 балла) также была значительно ниже, чем у пациентов, оперированных в условиях общей анестезии или одномоментной ЭА (4,8± 1,9 и 3,7± 1,1 баллов соответственно). У пациентов, оперированных под общей анестезией (группа 3), болевые ощущения развивались уже спустя 55-60 минут после окончания хирургического вмешательства и быстро достигали клинически значимой интенсивности.
Основываясь на современном определении адекватности послеоперационного обезболивания, согласно которому средняя интенсивность болевого синдрома по 10-бальной шкале не должна превышать 3 баллов [20], в первые сутки после операции анальгезию можно было признать удовлетворительной только у пациентов, оперированных в условиях СА. Значительное число пациентов, не удовлетворенных качеством послеоперационного обезболивания, обусловило высокие средние оценки интенсивности боли в данной группе. Пациенты, оперированные в условиях однократной ЭА (1-я группа), имели более длительный безболевой период и, первоначально отмечали более низкую интенсивность боли по сравнению с группой 3. Однако спустя 5-6 часов после операции значения средней интенсивности боли в группах 1 и 3 практически выравнивались. Естественно, что потребность в анальгетиках у больных 1-й и, особенно, 3-й групп превышала аналогичный показатель 2-й группы.
Таким образом, у пациентов, оперированных под спинальной анестезией, было отмечено наиболее благоприятное течение послеоперационного периода. Интересным является тот факт, что 38 пациентов 2-й группы (практически, каждый пятый) не нуждались в послеоперационном назначении анальгетиков, т.е. был достигнут превентивный эффект по отношению к развитию послеоперационного болевого синдрома.
Анализируя полученные результаты мы отметили, что они достаточно закономерно отражают отрицательную роль общей анестезии в формировании послеоперационного болевого синдрома. В ряде фундаментальных исследований последних лет было показано, что общая анестезия, устраняя перцепцию боли, не обеспечивает блокаду прохождения ноцицептивных импульсов ни на супрасегментарном, ни на спинальном уровне [5,1,11,25]. Суммарная доза опиоидных анальгетиков, введенных в системный кровоток, не обеспечивает достаточной блокады опиатных рецепторов задних рогов спинного мозга [6]. Слабоанестезированный спинной мозг во время операции подвергается мощной бомбардировке ноцицептивными стимулами, вызывающими пластические изменения ЦНС, лежащие в основе формирования послеоперационной гиперальгезии. Поэтому приоритетное значение в повышении качества интраоперационной защиты должно придаваться центральным нейрональным блокадам, т.е. эпидуральной и спинальной.
Основной вопрос при анализе полученных данных вызывало большее влияние спинальной анестезии на динамику послеоперационного болевого синдрома по сравнению с эпидуральной. Казалось бы, и СА и ЭА в равной степени обеспечивают адекватную афферентную блокаду ноцицептивных импульсов на сегментарном уровне и, следовательно, должны одинаково предупреждать развитие изменений функциональной активности структур ЦНС.
Основным различием двух рассматриваемых вариантов регионарной анестезии являлась различная протяженность сенсорной блокады, достигаемой эпидуральным и субдуральным введением местного анестетика. В первом случае верхняя граница сенсорного блока редко превышала уровень Т10, а нижняя зачастую не достигала сегментов S4-5. В то же время, субдуральное введение 4 мл 0,5% р-ра маркаина на уровне L3-4 в течение 15-20 минут позволяло обеспечить нейрональную блокаду протяженностью от Т5-6 до S5. Максимальное сегментарное распространение происходило в течение 15-20 минут и практически не зависело от положения больного в момент выполнения процедуры (в данном исследовании мы не применяли «тяжелый» спинальный маркаин). Следует подчеркнуть, что сегментарное распределение местного анестетика можно было, в определенной степени, регулировать изменением температуры препарата, дозой, скоростью и уровнем его введения. В частности, иньекция 0,5% маркаина через межпозвонковый промежуток L4-5 обеспечивала верхнюю границу блока максимум на уровне сегмента Т6, а введение препарата в L2-3 в ряде случаев позволяло поднять ее до уровня Т1-2. Снижение скорости иньекции препарата приводило к большему распределению анестетика в равной степени выше и ниже места иньекции. Увеличения сегментарного распределения можно было достичь согреванием раствора маркаина до 37 град.С.
Таким образом, мы предположили, что для оптимального предотвращение гиперактивации нейронов задних рогов спинного мозга необходима интраоперационная сенсорная блокада протяженностью Т5-S5, в то время, как ограниченная блокада не способна предупредить индуцированные изменения функциональной активности ЦНС.
Для проверки данного предположения было предпринято исследование состояния активности ноцицептивных нейронов задних рогов спинного мозга в послеоперационном периоде в зависимости от метода интраоперационной анестезии.
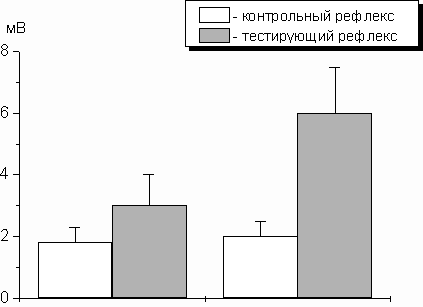
Оценивая периоперационную динамику амплитуды Н-рефлекса, в послеоперационном периоде мы отметили практически трехкратное возрастание величины тестирующего Н-ответа по сравнению с контрольным у пациентов, оперированных в условиях общей анестезии (Рис.1).
 |
 |
| А | Б |
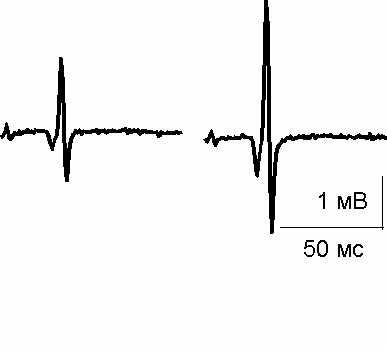
Рис.1. Динамика контрольного и тестирующего Н-рефлексов в послеоперационном периоде у пациентов, оперированных в условиях общей анестезии.
Вверху – средние величины контрольного и тестирующего Н-рефлексов до операции (А) и после операции (Б)
Внизу реальная запись Н-ответов у пациента, оперированного по поводу ложного сустава бедра.
По оси Y – амплитуда Н-рефлекса в милливольтах
Учитывая, что до операции амплитуда тестирующего Н-рефлекса увеличивалась лишь на 35% по сравнению с контрольным значением, можно сказать, что хирургическое вмешательство, выполненное в условиях общей анестезии, приводило к выраженной сенситизации ноцицептивных нейронов задних рогов спинного мозга. Величина контрольного Н-рефлекса на протяжении периоперационного периода у пациентов данной группы практически не изменялась.
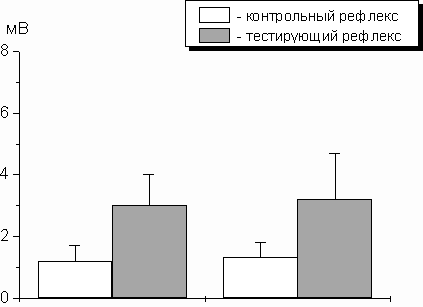
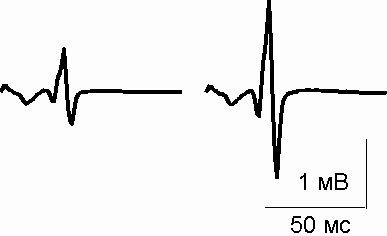
Аналогичное исследование у пациентов, перенесших операции в условиях спинальной анестезии, позволило заключить, что величина тестирующего Н-ответа в послеоперационном периоде не отличалась от дооперационных показателей (Рис.2).
 |
 |
| А | Б |
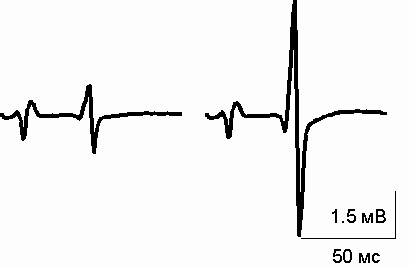
Рис.2. Периоперационная динамика амплитуды Н-ответа у пациентов, оперированных в условиях спинальной анестезии.
Вверху – средние величины контрольного и тестирующего Н-рефлексов до операции (А) и после операции (Б)
Внизу реальная запись Н-ответов у пациента, оперированного по поводу перелома костей голени.
По оси Y – амплитуда Н-рефлекса в милливольтах
Амплитуда контрольного Н-ответа также не отличалась от аналогичного показателя, зарегистрированного накануне операции. Этот факт свидетельствовал о снижении возбудимости нейромоторного аппарата спинного мозга за счет его адекватной защиты от ноцицептивных воздействий при помощи спинальной анестезии. На основании полученных данных можно было сделать вывод, что операционная травма в данной ситуации не приводила к сенситизации спинальных нейронов.
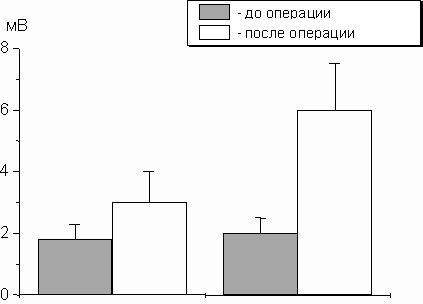
И, наконец, сравнительная оценка амплитуды тестирующего Н-рефлекса выявила ее существенное возрастание в послеоперационном периоде у пациентов, прооперированных в условиях одномоментной эпидуральной анестезии по сравнению со спинальной (рис.3).
1 |
2 |
Рис 3. Изменение средней амплитуды тестирующего Н-рефлекса в периоперационном периоде в зависимости от методики анестезии во время операции.
1 – динамика тестирующего Н-рефлекса у пациентов, оперированных в условиях спинальной анестезии, 2 – аналогичный показатель у больных, оперированных в условиях эпидуральной анестезии.
По оси Y – средняя амплитуда тестирующего Н-ответа в милливольтах
Данное наблюдение соответствовало клиническим данным о более выраженном превентивном эффекте СА по сравнению с ЭА по отношению к развитию болевого синдрома и позволяло сделать вывод о более эффективном предупреждении сенситизации ноцицептивных нейронов ЗРСМ при помощи спинальной анестезии.
Несмотря на то, что Н-рефлекс является спинальным моносинаптическим рефлексом и его амплитудно-временные параметры во многом определяются возбудимостью мотонейронов, важную роль играет тот факт, что последние испытывают на себе постоянное облегчающее и тормозное влияние со стороны интернейронов, обеспечивающих передачу информации к мотонейронам как от ноцицептивных нейронов задних рогов спинного мозга, так и от супраспинальных структур, участвующих в восприятии и анализе “болевых” сигналов [2].
Феномен центральной сенситизации, наряду с повышением возбудимости и реактивности ноцицептивных нейронов, подразумевает и дефицит тормозных реакций, в результате чего облегчаются синаптические межнейрональные взаимодействия, происходит активация “молчащих” неактивных синапсов и объединение близлежащих сенситизированных нейронов в единые агрегаты [3].
Эта совокупность центральных нейропластических изменений и обеспечивает усиленный синхронный разряд a -мотонейронов, который мы наблюдали у пациентов в послеоперационном периоде.
В ряде исследований последних лет, посвященных предотвращению развития хирургического стресс-ответа, также было высказано предположение об оптимальной протяженности сенсорного блока Т5-S5 [16,21,18]. Очевидно, ограниченная сенсорная блокада не обеспечивает полной блокады повреждающих импульсов всех модальностей. В частности, степень симпатического блока, достигаемая при помощи эпидуральной анестезии, до сих пор является предметом дискуссий. При этом известно, например, что симпатические преганглионарные волокна от сосудов нижних конечностей распространяются в краниальном направлении до уровня Т6-9, где соединяются с волокнами нисходящими от Т2-5, иннервирующими верхние конечности [9].
В свое время H.Kehlet, анализируя результаты недостаточной эффективности ЭА в профилактике хирургического стресс-ответа отметил, что одной из основных причин является недостаточная афферентная и эфферентная симпатическая блокада, а блокада чревного сплетения, дополняющая ЭА, способствует снижению стресс-ответа [16]. Имеются отдельные сообщения о преимущественном влиянии на кортизоловый ответ спинальной анестезии по сравнению с эпидуральной, даже при верхне-абдоминальных операциях [10].
Таким образом, на основании анатомических данных можно полагать, что спинальная анестезия в отличие от эпидуральной не только обеспечивает адекватную соматосенсорную блокаду, но гарантирует и достаточную симпатическую блокаду.
Основываясь на современных представлений о механизмах влияния операционной травмы на организм человека, мы считаем, что степень адекватности анестезии, в первую очередь, должна определяться ее способностью предотвратить индуцированную ноцицептивной стимуляцией гиперактивацию сегментарных структур ЦНС, в частности, нейронов задних рогов спинного мозга. Полученные данные позволяют сделать вывод о преимущественной роли спинальной анестезии в достижении этой цели, по крайней мере, при операциях на нижней половине туловища.
ВЫВОДЫ.
-
Гиперактивация сегментарных структур ЦНС с
формированием интенсивного послеоперационного болевого синдрома является
одним из основных проявлений агрессивного воздействия операционной
травмы на организм человека.
- Общая анестезия, устраняя перцепцию боли, не препятствует формированию индуцированной хирургическим вмешательством гипервозбудимости ноцицептивных нейронов задних рогов спинного мозга, и, с этих позиций, не может считаться адекватной.
- Эпидуральная анестезия оказывает ограниченное предупреждающее влияние на изменения функциональной активности сегментарных структур ЦНС, что объясняется ограниченной протяженностью сенсорного блока и недостаточной степенью афферентной симпатической блокады.
- Спинальная анестезия в большей степени предотвращает индуцированные операционной травмой изменения реактивности ноцицептивных нейронов задних рогов спинного мозга, что позволяет рассматривать ее как наиболее адекватный метод анестезии при операциях на нижней половине туловища.
ЛИТЕРАТУРА.
Абрамов Ю.Б. Нейрофизиологический анализ начальных этапов развития общей анестезии.: дисс... док. мед. наук. - М.,1986. -349 С.
Байкушев С.Т., Манович З.Х., Новикова В.П. Стимуляционная электромиография и электронейрография в клинике нервных болезней. - М.,Медицина. - 1974.
Крыжановский Г.Н. Общая патофизиология нервной системы. - М,Медицина. - 1997.- 350 С.
Кукушкин М.Л, Сыровегин А.В, Гнездилов А.В. и др. // Анест.и реаниматол.- 1998.- N.5. - С.16-19.
Осипова Н.А. Оценка эффекта наркотических, анальгетических и психотропных средств в клинической анестезиологии.-Л.:Медицина,1988.-256 C.
Abram S.E., Olson E.E. // Anеsthеsiology.-1994.- V.80.- P.1114-1119.
d’Amours R, Riegler F, Little A. // Chest.Surg.Clin.N.Am.-1998.-V.8.-P.703-722.
Beauregard L., Pomp A., Choiniere M. // Can.J.Anaesth. – 1998.– V.45.– P.304-311.
Bonica J.,Loeser J.,Charman C.,Fordyce W. The Management Of Pain (Eds.by Bonica J.), 2nd Ed.- Philadelphia, Lea & Febiger,1990.
Carli F., Barnard M., Webster J. // Br.J.Anaesth.- 1991.- V.67.- P.567-571.
Coderre T.J., Katz J., Vaccarino A.L., Melzack R. // Pain.-1993.-V.52.- 259-285.
Dahl J.B, Erichsen C, Fuglsang-Frederiksen A, Kehlet H. // Brit.J.Anaesth. - 1992. - V.69. - P.117.
Dubner R. // Proceed.6th World Congr.Pain.- Amsterdam,1991.- P.263-276.
Dubuisson D., Dennis S.G. // Pain.- 1977.- V.4. - P.161-174.
Katz J., Jackson M., Kavanagh B., Sandler A. // Clin.J.Pain. - 1996.- V.12.- P.50-55.
Kehlet H. // Br.J. Anaesth.- 1989.- V.63.- P.189-195.
Kenshalo D.R., Leonard R.B., Chung J.M., Willis W.D. // J.Neurophysiol.- 1979.- V.42.- P.1370-1389.
- Liu S, Carpenter R., Neal J. // Anesthesiology.- 1995.- V.82.- P.1474-1506.
Perl E.R. // Neural.Mech.Pain.- New York,1983.- P.23-51.
Rawal N. // Reg.Anesth.Pain.Med. – 1999. – V.24. – P.68-73.
Shir Y., Raja S.N., Frank S.M. // Anesthesiology. -1994.- V.80.- P.49-56.
Thomas T., Robinson C., Champion C. et al. // Pain.- 1998.- V.75. – P.177-185.
Wall P.D. // Pain.-1988.- V.33.- P.289-290.
Woolf C.J., Wall P.D. // Neurosci. Lett.- 1986.- V.64.- P.221-225.
Woolf C.J., Chong M.S. // Anesth.Analg.- 1993.- V.77.- P.1-18.
