Продленная блокада плечевого сплетения аксиллярным доступом у детей
Продленная блокада плечевого сплетения аксиллярным доступом у детей
Лешкевич А. И., Ражев С.В., Михельсон В.А., Сидоров В.А.
Детская городская
клиническая больница №13 им. Н. Ф. Филатова г. Москва
( главный
врач Лукин Г.И.,).
Кафедра детской хирургии РГМУ
( зав. кафедрой -
академик РАМН, проф. Исаков Ю.Ф.)
URL
Первое сообщение о катетеризации
периневрального пространства плечевого сплетения надключичным
доступом было сделано Ansbro в 1946 году (1). Sеlander (1977)
предложил вводить в периваскулярное пространство катетер аксиллярным
доступом и настаивал на рутинном использовании катетеризации,
чтобы избежать добавления к раствору местного анестетика вазоконстрикторов
для увеличения длительности блокады, а также для того, чтобы сделать
возможным введение дополнительных доз местного анестетика в тех
случаях, если недостаточный объем первой дозы привел к недостаточной
блокаде (2).
После этих работ продленная анестезия плечевого сплетения получила
широкое распространение при обезболивании хирургических вмешательств
на верхней конечности и в послеоперационном периоде. К сожалению,
на раннем этапе методика имела много недостатков, но введение
в практику специальных наборов для продленной анестезии сделало
проведение катетеризации периневрального пространства нервных
сплетений более простой, легко выполнимой и контролируемой.
Концепция о том что, плечевое сплетение на всем своем протяжении
от корешков спинномозговых нервов и до терминальных отделов окружено
периневральным периваскулярным пространством, разработанная Winnie
и соавт., стала особенно популярной и явилась основой метода блокады
плечевого сплетения однократной инъекцией (Single - shot). Распространение
анестезии при этом зависит, как и при эпидуральной анестезии,
от объема введенного местного анестетика и от уровня, на котором
его ввели (межлестничный, подключичный или аксиллярный). Введение
катетера в это периваскулярное пространство позволяет поддерживать
длительную аналгезию, без повторного проведения пункции влагалища
плечевого сплетения, что важно в педиатрической анестезиологической
практике (3).
Разработка местных анестетиков амидного ряда длительного действия,
таких как бупивакаин и ропивакаин, значительно сократила потребность
в длительной блокаде плечевого сплетения при операциях. Однако,
в связи с тем, что ни один из местных анестетиков не способен
обеспечить обезболивание свыше 24 часов даже в комбинации с анальгетиками
опиоидного ряда, а как правило, 17% детей испытывают боли на 2
сутки после операции, существует необходимость во внедрении в
практику детского анестезиолога продленных методов регионарной
анестезии, которые позволяют адекватно решать проблему интра-
и послеоперационного обезболивания (4).
В настоящее время основными показаниями для проведения продленной
проводниковой анестезии плечевого сплетения у детей являются:
операции по поводу тяжелых травм верхних конечностей , требующие
длительных оперативных вмешательств свыше 2 часов, необходимость
длительного обезболивания в послеоперационном периоде ( до нескольких
суток ), острые и хронические боли верхних конечностей.
Целью данной работы явилось изучение возможности повышения эффективности
метода аксиллярной блокады с помощью катетеризации периневрального
пространства плечевого сплетения и разработка режимов постоянной
инфузии местных анестетиков амидного ряда в периневральное пространство
плечевого сплетения в интра- и послеоперационном периоде у детей.
Материал и методы.
Работа основана на изучении влияния на гемодинамику и
анализе аналгетической эффективности метода продленной аксиллярной
блокады плечевого сплетения у двух групп больных в интра- и послеоперационном
периодах. Принципиальное отличие между исследуемыми группами было
связано с используемым для регионарной блокады амидным местным
анестетиком.
Все больные были разделены на две группы в зависимости от применяемого
амидного местного анестетика.
Создание аксиллярной блокады плечевого сплетения у детей первой
группы осуществлялось однократным болюсным введением 0,25% раствора
бупивакаина (1-2 мг/кг) после индукции анестезии и постоянной
инфузией 0,125% бупивакаина в послеоперационном периоде со скоростью
0,2-0,3 мл/кг/час.
Во второй группе больных использовался 1% лидокаин, болюсная доза
которого составляла 5 мг/кг во время оперативного вмешательства
и инфузия 0,5% раствора в послеоперационном периоде со скоростью
0,4 - 0,5 мл/кг/час.
Исследование выполнено у 40 детей в возрасте от 4 до 14 лет, оперированных
в хирургическом стационаре и отделении анестезиологии и реанимации
Детской городской клинической больницы им. Н.Ф. Филатова, г. Москвы
в период с марта 1994 г. по сентябрь 1998 г.
Продленная блокада плечевого сплетения аксиллярным доступом проводилась
у детей, оперированных на верхней конечности в области нижней
трети плечевой кости, локтевого сустава, предплечья и кисти. Распределение
детей по возрасту и зоне оперативного вмешательства представлены
в таблице 1.
Таб 1. Распределение детей по возрасту и зоне оперативного вмешательства.
|
Область операции |
Возраст (годы) | ||||
|
4 - 6 |
7 - 10 |
10 - 12 |
12 - 14 |
||
|
Кисть |
4 |
4 | |||
|
Предплечье |
1 |
12 |
6 |
4 |
23 |
|
Локтевой сустав |
2 |
5 |
3 |
2 |
12 |
|
Нижняя треть плеча |
1 |
1 | |||
|
7 |
18 |
9 |
6 |
40 | |
Таблица 2. Распределение больных по группам, характеру оперативного вмешательства и возрасту.
|
Возраст( годы) |
Диагноз (оперативное вмешательство) |
1 группа |
2 группа |
|
4 - 7 лет |
Синдактилия |
1 1 1
|
2 1
1 |
|
7 - 10 лет |
Деформация костей
предплечья |
3 2 1 1
2 1 |
3 3 2
2 |
|
10 - 12 лет |
Отрыв надмыщелка плечевой кости |
1 1 2 |
1 1 2 |
|
12 - 14 лет |
Отрыв надмыщелка плечевой кости
) |
1 1 1 |
1 1 1 |
|
20 |
20 |
Продленная блокада плечевого
сплетения аксиллярным доступом проводилась после индукции в общую
анестезию, но до начала оперативного вмешательства.
Премедикация у всех
детей проводилась за 45 минут до индукции общей анестезии по стандартной
схеме: внутримышечное введение 0,1% раствора атропина в дозе 0,1 мг/кг
массы тела и 0,5% раствора диазепама в дозе 0,2 - 0,3 мг/кг массы
тела.
Общая анестезия проводилась по общепринятой методике в
зависимости от длительности оперативного вмешательства.
Для проведения
блокады используются стандартные наборы "Сontiplex" для продленной
проводниковой анестезии немецкой фирмы B. Braun. В такой одноразовый набор
входят: тефлоновая канюля 1,2 Х 45 мм на игле с короткой заточкой 30
градусов, 5 мл шприц Омнификс Лок с подогнанным поршнем и полиамидный
катетер длинной 40 см, устойчивый на изгиб, с маркировкой длины для
контроля глубины введения и муфтой (каталожный номер изделия 0489 3603).
Манипуляция проводится в строго асептических условиях, как при
катетеризации центральных вен. Набор для катетеризации укладывается на
стерильный столик, прикрытый стерильной пеленкой. Использование стерильных
хирургических перчаток во время катетеризации является обязательным.
Пациент лежит на спине, плечо отведено от туловища на 90 градусов,
предплечье согнуто и ротировано наружу так, чтобы тыльная часть кисти
лежала на столе рядом с головой пациента. После обработки йодом и спиртом,
место пункции обкладывается стерильной пеленкой. В шприц набирается 0.9%
физиологический раствор, присоединяется катетер на игле. Пальпируют
подмышечную артерию и, удерживая указательный палец на пальпируемой
артерии, продвигают его проксимально к верхушке подмышечной ямки. Место
вкола находится дистальнее на 1 - 1,5 см от места исчезновения пульсации
плечевой артерии в самом глубоком месте аксиллярного влагалища. Катетер на
игле вводят сразу над кончиком указательного пальца по направлению к
верхушке подмышечной ямки так, чтобы достигнуть артерию под углом 10 - 20
градусов. Иглу продвигают медленно, пока не будет достигнут характерный
“щелчок” при проникновении иглы через аксиллярное фасциальное влагалище
плечевого сплетения. При непреднамеренной пункции артерии и получении
рефлюкса крови в шприце, иглу удаляют и сдавливают сосудисто-нервный пучок
для остановки кровотечения из поврежденной артерии, но пункция артерии не
является противопоказанием для проведения блокады. После остановки
кровотечения пункцию периневрального пространства можно повторить или
перейти на проведение анестезии альтернативными методами. Четкими
критериями нахождения иглы в периневральном пространстве,
являются:
Ощущение фасциального "щелчка" при пенетрации периневрального
пространства.
Явная пульсация иглы в такт подмышечной артерии.
При
выполнении блокады в сознании ощущение парестезий в зонах иннервации
плечевого сплетения.
Легкое введение анестетика в периневральное
пространство.
После аспирационной пробы вводят медленно 3 - 5 мл
физиологического раствора, повторяя аспирационную пробу несколько раз в
момент инъекции. После извлечения иглы через канюлю осторожным движением
вводится катетер на глубину 1 - 3 см. За глубиной введения следят по
маркировке, нанесенной на катетер. Свободное прохождение катетера и легкое
поступление физиологического раствора служит критерием, свидетельствующим
о правильном нахождении катетера в периневральном пространстве.
На
катетер надевают заглушку, закрепляют в подмышечном пространстве, как при
перидуральной анестезии. Последующее введение анестетика постоянно
сопровождается аспирационной пробой после каждых 2 мл введенного
препарата. Во время операции заглушка катетера должна быть обложена
стерильными марлевыми салфетками, а введение анестетика желательно
проводить через бактериальный фильтр с соблюдением всех правил асептики
для предотвращения развития инфекции в месте нахождения катетера.
Наложение отжимающего жгута на верхнюю треть плеча требуется при
большинстве операций травматологического профиля, поэтому необходимо
следить, чтобы не происходило смещения катетера при данной манипуляции.
После наложения турникета следует убедиться, что при аспирационной пробе
нет рефлюкса крови в катетере, а анестетик при введении поступает
свободно. Жгут, как правило, не сдавливает катетер и не мешает свободному
поступлению анестетика, но при обнаружении трудностей необходимо
предупредить хирурга и коллегиально решить вопрос об их устранении или
перейти на альтернативные методы анестезии.
После введения первой
болюсной дозы местного анестетика анестезиолог должен решить вопрос о
поддержании адекватной концентрации местного анестетика в периневральном
пространстве. При использовании лидокаина в дозе и объеме в зависимости от
возраста (обычно 5 мг/кг), предпочтительней выглядит постоянная инфузия
анестетика через инфузионную помпу, в силу короткого фармакологически
эффективного периода его действия (90 - 120 мин). Инфузия 0,5% раствора
лидокаина в дозе 0,4 - 0,5 мл/кг/час начиналась через 30 мин. после
нагрузочного болюса и продолжалась в течение всей операции. По окончанию
операции инфузия временно прекращалась до появления симптомов
неэффективной аналгезии, что позволяло оценить адекватность и зону
созданного аксиллярного блока.
Бупивакаин, как анестетик длительного
обезболивающего периода, вводился во время операции болюсно в дозе 1-2
мг/кг 0,25% раствора, а в послеоперационном периоде, как правило через 6
часов после первого введения, налаживалась постоянная инфузия 0,125%
раствора бупивакаина со скоростью 0,2 - 0,3 мл/кг/час.
Обязательный
мониторинг во время оперативного вмешательства включает: неинвазивное
артериальное давление, ЭКГ, пульсовую оксиметрию и капнометрию. Показатели
регистрируются с помощью монитора HP M1205 A OmniCare Model 24/24C
("Hewlett packard") от начала индукции анестезии и до полного пробуждения
больного после окончания операции.
В данной работе эффективность
используемой расчетной болюсной дозы местного анестетика и последующей
скорости инфузии при операциях на верхней конечности оценивалась на
основании отсутствия симптомов ноцицептивной гемодинамической
реакции.
С этой целью, у 40 больных (20 детей 1 группы, и 20 - 2 группы
) в возрасте от 4 до 14 лет проводился неинвазивный мониторинг параметров
центральной гемодинамики: артериальное давление (АД) (систолическое,
диастолическое, среднее), частота сердечных сокращений (ЧСС), минутный
объем сердца (МОС), ударный объем (УО).
Мониторинг МОС, УО и ЧСС
проводился с помощью неинвазивного компьютерного сердечного выброса NCCOM3
(BOMED, США); для регистрации неинвазивного АД ( систолическое,
диастолическое, среднее) использовался монитор HP M1205A OmniCare Model
24/24C ("Hewlett packard").
Показатели центральной гемодинамики
определялись перед операцией, во время начала операции, т.е. во время
кожного разреза, на 30 минуте от момента введения анестетика в
периневральное пространство плечевого сплетения, в динамике на протяжении
всей операции. Неинвазивный монитор сердечного выброса NCCOM3 позволял
регистрировать средние значения УО, МОС и ЧСС для каждых 10 сердечных
сокращений. Измерение неинвазивного артериального давления проводилось
монитором 10 - минутным интервалом.
Мониторинг показателей центральной
гемодинамики, отражающих эффективность нейрональной блокады после начала
инфузии 0,125% раствора бупивакаина (первая группа), осуществлялся с
интервалом в 1 час на протяжении 24 часов у 17 детей (85%) и у 3 пациентов
(15%) в течении 48 часов послеоперационного периода. Проявления
ноцицептивной гемодинамической реакции оценивались на основании изменений
минутного объема сердца, ударного объема, частоты сердечных сокращений,
артериального давления (систолическое, диастолическое, среднее). У детей
второй группы ( лидокаин 1% ) мониторинг центральной гемодинамики
осуществлялся на протяжении 24 часов послеоперационного периода с
интервалом в 1 час и состоял из показателей артериального давления (АД
систолическое, АД диастолическое, АД среднее.), частоты сердечных
сокращений, сердечного выброса и ударного объема. Регистрация
артериального давления и частоты сердечных сокращений в послеоперационном
периоде выполнялось с помощью неинвазивного монитора. Для измерения
артериального давления использовали возрастной размер манжетки и
результаты сравнивались с контрольным значением полученным до операции.
Превышение показателей центральной гемодинамики на 10% и более по
сравнению с исходными данными, у больных обеих групп расценивалось как
ноцицептивная гемодинамическая реакция.
Кроме того, в настоящем
исследовании эффективность продленной проводниковой анестезии плечевого
сплетения оценивалась на основании “визуально аналоговой шкалы боли”
предложенной фирмой "ASTRA". Субъективная оценка боли включает 4 категории
болевых ощущений:
"Нет боли" 0 - 25 баллов.
"Умеренная боль" 25 -
50 баллов.
"Сильная, но терпимая боль" 50 - 75 баллов.
"Мучительная нестерпимая боль" 75 - 100 баллов.
Динамическая
оценка продленной блокады плечевого сплетения с помощью выбранной “шкалы
боли” проводилась с момента перевода больного в палату пробуждения и на
протяжении 24 - 48 часов послеоперационного периода с интервалом в 1 час
или при появлении изменений в состоянии больного. Оценка адекватности
обезболивания с помощью “шкалы боли” проводилась врачом анестезиологом.
Общая сумма баллов менее 25 расценивалась как удовлетворительная
анальгезия.
Результаты исследования и их
обсуждение
Эффективность продленной аксиллярной блокады
плечевого сплетения оценивалась на основании появления симптомов
ноцицептивной гемодинамической реакции (тахикардия, артериальная
гипертензия, увеличение ударного объема и сердечного выброса).
Анализ
показателей центральной гемодинамики полученных на 30 минуте от момента
введения болюса амидного местного анестетика в обеих группах в аксиллярное
периневральное пространство, не выявил статистически достоверных изменений
исследуемых параметров. Снижение показателей УО, СВ, АД не превышало 5% (р
< 0,005). Это свидетельствовало об отсутствии эффектов выраженной
симпатической блокады на введение используемого объема местного
анестетика. В то же время, отсутствие ноцицептивной гемодинамической
реакции на кожный разрез являлось доказательством эффективности созданного
аксиллярного блока.
На протяжении всего оперативного вмешательства
(длительность оперативного вмешательства составила в среднем 72,86 часа)
отмечалась стабильность показателей гемодинамики: колебания АД, ЧСС, УО и
СВ не превышали 5%-10%. Ни одному ребенку не требовалось дополнительное
введение фентанила или увеличение концентрации ингаляционного
анестетика.
Анализ показателей центральной гемодинамики у 20 пациентов
1 - ой группы показало отсутствие симптомов ноцицептивной гемодинамической
реакции на протяжении 6 часов послеоперационного периода. Сумма баллов по
"шкале боли" в этот период не превышала 10 - 20. Через 6 часов от момента
создания аксиллярного блока 0,25% раствором бупивакаина отмечалось
достоверное увеличение показателей АД, ЧСС, УО, МОК на 10 - 30%, что было
расценено как реакция гемодинамики на появление выраженного болевого
синдрома вследствие истощения созданного аксиллярного блока. Сумма баллов
по "шкале боли" превышала 20 - 25. После начала инфузии 0,125% раствора
бупивакаина со скоростью 0,2 - 0,3 мл/кг/час показатели гемодинамики
возвращались к исходным показателям и имели незначительные колебания до
окончания инфузии бупивакаина в течении 24 часов у 17 и 48 часов у 3
пациентов. ( диаграмма 1)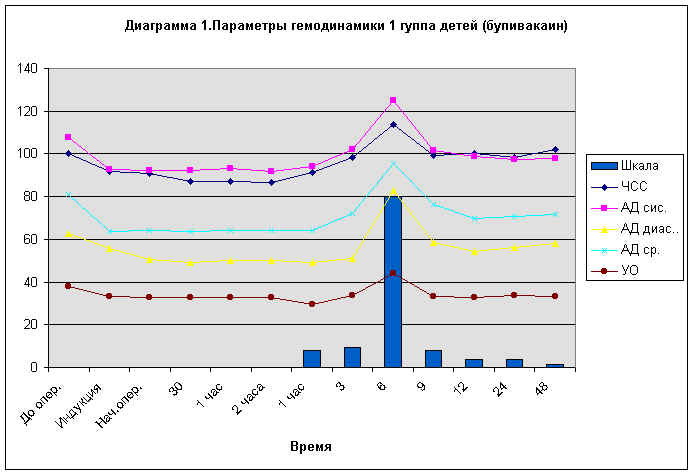
Во второй группе
детей аксиллярный блок, который создавался с использованием 1% раствора
лидокаина, также во время оперативного вмешательства отмечалась
стабильность гемодинамических показателей. В послеоперационном периоде
через 1 час у 60% детей и через 3 часа у 40% после создания блока
отмечалось повышение гемодинамических показателей на 10 - 30% от исходных
величин и увеличение показателей шкалы боли свыше 25 баллов,
свидетельствующая о появлении болевого синдрома и необходимости начала
инфузии местного анестетика. После начала инфузии 0,5% раствора лидокаина
показатели гемодинамики вернулись к исходным показателям и оставались
стабильными на протяжении 24 часов постоянной инфузии местного анестетика.
(диаграмма 2)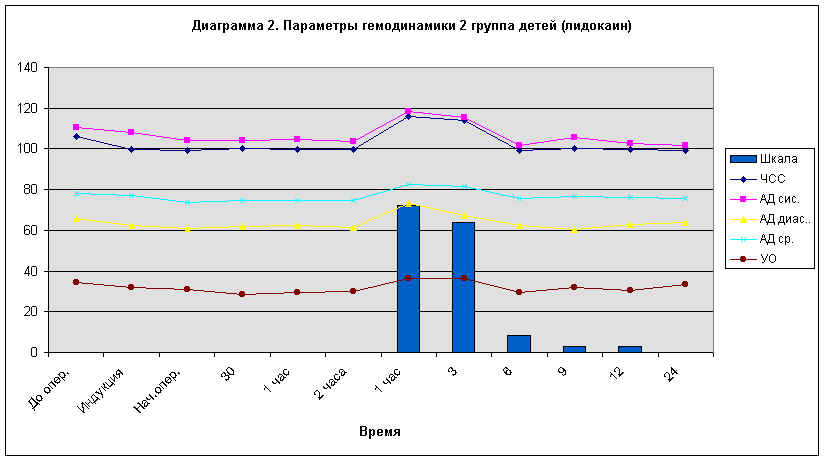
Выбранные режимы инфузии для
бупивакаина и лидокаина не вызвали клинических симптомов токсических
реакций ни у одного обследуемого ребенка. У 3 (15%) детей из второй группы
в послеоперационном периоде появился болевой синдром , который мы
объяснили недостаточной скоростью введения анестетика. После увеличения
скорости инфузии 0,5% раствора лидокаина с 0,4 мл/кг/час до 0,5 мл/кг/час
болевой синдром был купирован. В первой группе детей, у которых применялся
бупивакаин, сумма баллов по шкале боли всегда оставалась менее 25,
проявлений болевой реакции со стороны гемодинамики не отмечалось.
Выводы
Продленная блокада плечевого сплетения
аксиллярным доступом является эффективным методом аналгезии при операциях
в области нижней трети плечевой кости, локтевого сустава, предплечья и
кисти. Метод может успешно применяться у детей в интра- и
послеоперационном периоде.
Продленная аксиллярная блокада, создаваемая
болюсным введением 1% раствора лидокаина в дозе 5 мг/кг и последующей
постоянной инфузией 0,5% раствора лидокаина в течении 24 часов со
скоростью 0,4 - 0,5 мл/кг/час позволяет поддерживать эффективную аналгезию
в области нижней трети плечевой кости, локтевого сустава и кисти.
Продленная блокада плечевого сплетения аксиллярным доступом,
создаваемая болюсным введением 0,25% раствора бупивакаина в дозе 1-2
мг/кг/час и последующей постоянной инфузией 0,125% раствора со скоростью
0,2 - 0,3 мл/кг/час, создает эффективный уровень аналгезии в течение 48
часов.
Проведенный в течении всего периода времени постоянной инфузии
клинический и гемодинамический мониторинг не выявил побочных токсических
эффектов рекомендуемых скоростей инфузии лидокаина и бупивакаина.
Список литературы
1.Ansbro, F.P., Method of continuous brachial plexus block, Am.J. Surg.,71,716,1946
2.Selander, D., Catheter technique in axillary plexus block - presentation of new method, Acta Anaesthesiol. Scand., 21,324,1977.
3.Winnie, A.P.,: Plexus Anesthesia. Perivascular Techniques of Brachial Plexus Block. WB Saunders, Philadelphia, 1983.
4.Послеоперационная боль. Руководство.Пер. с англ./Под ред. Ф.Майкла Ферранте, Тимоти Р. 5.ВейдБонкора.-М.:Медицина, 1998. с.5.
