Офтальмология-Эндокринная офтальмопатия с позиций офтальмолога и эндокринолога
Эндокринная офтальмопатия с позиций офтальмолога и эндокринолога
Профессор А.Ф. Бровкина, Т.Л. Павлова
Московский НИИ глазных болезней им. Гельмгольца, Минздрава РФ, Эндокринологический научный центр РАМН
URL
ервые сведения об эндокринном экзофтальме появились в 1776 г, когда Грейвс описал случай заболевания щитовидной железы, сопровождавшийся выпячиванием глаза. Офтальмопатия как самостоятельное заболевание была описана спустя 50 лет у женщины при гипертиреозе. Более детально эндокринную офтальмопатию начали изучать в конце 40-х годов ХХ века. И тогда выяснилось, что больные, страдающие заболеванием щитовидной железы с вовлечением органа зрения, встречаются достаточно часто. В медицинской литературе на протяжении всех этих лет продолжается дискуссия о причине выпячивания глаза, высказываются суждения о том, какие ткани в орбите страдают в первую очередь. Споры породили множество названий данной патологии: офтальмопатия Грейвса, тиреотропный экзофтальм, тиреотоксический экзофтальм, эндокринный экзофтальм, отечный экзофтальм, злокачественный экзофтальм, нейродистрофический экзофтальм, инфильтративная офтальмопатия, экзофтальмическая офтальмопатия, тиреоидная офтальмопатия, эутиреоидная офтальмопатия, дистиреоидная офтальмопатия, эндокринная офтальмопатия. Множество синонимов, используемых в литературе до последнего времени, свидетельствует об отсутствии цельной концепции этиологии и патогенеза этого крайне тяжелого заболевания. Мы остановились на термине “эндокринная офтальмопатия” (ЭОП), дальнейшие наблюдения подтвердили правильность такого выбора [1].
В основе патологического процесса ЭОП лежит поражение мягких тканей орбиты на фоне нарушенной функции щитовидной железы. Характер и степень поражения щитовидной железы при этом могут быть различными.
При длительном наблюдении за 925 больными с ЭОП в возрасте от 14 до 77 лет (средний возраст 42 года) дисфункция щитовидной железы была обнаружена у 81,5% больных, из них у 73,4% – гиперфункция, у 8,1% – гипофункция. У 18,5% больных на фоне выраженной картины ЭОП эндокринологи констатировали эутиреоидное состояние. Однако хорошо известно, что глазные симптомы могут появиться как до клинических проявлений гипертиреоза, так и спустя 15 и даже 20 лет после его возникновения. И действительно, около 78% наших больных к моменту обращения к офтальмологу длительное время получали медикаментозное лечение по поводу гипертиреоза. В то же время офтальмологам известны случаи появления ЭОП у больных, перенесших операцию на щитовидной железе. Чаще это происходит в случаях тотального удаления щитовидной железы. Ввиду отсутствия временной корреляции между появлением симптомов ЭОП и признаков дисфункции щитовидной железы, появившийся в последние годы термин “эутиреоидная болезнь Грейвса” [2], вероятно, будет пересмотрен.
Патогенез
На протяжении многих лет дискутируется вопрос о том, что является объектом первичной атаки патологического процесса в орбите: ее клетчатка или экстраокулярные мышцы. Вопрос о первичной мишени иммунного ответа до настоящего времени не решен. Большинство исследователей считают, что ретробульбарная клетчатка является первоначальной антигенной мишенью при ЭОП [3, 4]. Именно на перимизиальных фибробластах, эндотелии сосудов жировой ткани, а не на экстраокулярных миоцитах была обнаружена экспрессия маркеров ЭОП (теплошоковых протеинов 72 кД, HLA-DR-антигенов, межклеточных молекул адгезии ICAM-1, молекул эндотелиальной адгезии лимфоцитов). Образование адгезирующих молекул, экспрессия HLA-DR приводят к инфильтрации ретробульбарных тканей иммуноцитами и запуску иммунных реакций [2, 4].
Причины избирательного поражения мягких тканей орбиты, возможно, кроются в следующем. Не исключено, что фибробласты орбиты имеют собственные антигенные детерминанты, которые и распознает иммунная система [5, 6]. Предполагается, что фибробласты орбиты (преадипоциты), в отличие от фибробластов других локализаций, способны к дифференцировке в адипоциты in vitro [3, 7].
Эндокринная офтальмопатия – аутоиммунное заболевание, проявляющееся патологическими изменениями в мягких тканях орбиты с вторичным вовлечением глаза. В настоящее время существуют две теории патогенеза ЭОП.
Согласно одной из них, в качестве возможного механизма рассматривают перекрестное реагирование антител к щитовидной железе с тканями орбиты, наиболее часто встречающееся при диффузном токсическом зобе (ДТЗ). На это указывает частое сочетание (в 70% случаев) ЭОП и ДТЗ [8] и частое одновременное их развитие, уменьшение выраженности глазных симптомов при достижении эутиреоза. У больных с ДТЗ и ЭОП отмечается высокий титр антител к рецептору тиреотропного гормона (ТТГ), который снижается на фоне тиреостатической терапии [3, 9].
По мнению других авторов, ЭОП – самостоятельное аутоиммунное заболевание с преимущественным поражением ретробульбарных тканей. В 5–10% случаев при ЭОП не выявляется дисфункции щитовидной железы [10]. При ЭОП выявляются антитела к мембранам глазодвигательных мышц (с мол. массой 35 и 64 кД; антитела, стимулирующие рост миобластов) [11, 12], фибробластам и орбитальной клетчатке. Причем антитела к глазодвигательным мышцам выявляются не у всех больных, в то время как антитела к орбитальной клетчатке можно считать маркером ЭОП [3, 13]. На рис.1 представлен патогенез ЭОП [13, 14]. Под действием пусковых механизмов, возможно, вирусной или бактериальной инфекции (ретровирусы, Yersenia enterocolitica), токсинов, курения, радиации, стресса у генетически предрасположенных лиц в мягких тканях орбиты экспрессируются аутоантигены. При ЭОП имеется антигенспецифический дефект Т-супрессоров. Это делает возможным выживание и размножение клонов Т-хелперов, направленных против аутоантигенов щитовидной железы и мягких тканей орбиты. В ответ на появление аутоантигенов Т-лимфоциты и макрофаги, инфильтрируя ткани орбиты, высвобождают цитокины.
Цитокины индуцируют образование молекул основного комплекса гистосовместимости II класса, теплошоковых протеинов и адгезивных молекул. Цитокины стимулируют пролиферацию ретробульбарных фибробластов, выработку коллагена и гликозаминогликанов (ГАГ). ГАГ с белками образуют протеогликаны, способные связывать воду и вызывать отек мягких тканей орбиты.
При гипертиреозе дефект иммунологического контроля усугубляется: при декомпенсированном ДТЗ уменьшается количество Т-супрессоров. При ДТЗ снижается также активность естественных киллеров, что приводит к синтезу аутоантител В-клетками и запуску аутоиммунных реакций.
Развитие ЭОП при гипотиреозе можно объяснить следующим образом. В норме трийодтиронин (Т3) ингибирует синтез ГАГ. При гипотиреозе в связи с дефицитом Т3 ингибирующий эффект уменьшается. Кроме того, высокий уровень ТТГ приводит к увеличению экспресии HLA-DR на тиреоцитах, что усиливает патологический процесс в орбитах [14].
Клиническая картина
Клинические наблюдения за больными с ЭОП позволяют выделить три самостоятельных формы заболеваний: тиреотоксический экзофтальм, отечный экзофтальм и эндокринную миопатию. В ходе развития патологического процесса тиреотоксический экзофтальм может перейти в отечный экзофтальм, который может завершиться картиной эндокринной миопатии. При последних двух формах морфологически в экстраокулярных мышцах и орбитальной клетчатке в начале процесса наблюдают интенсивную клеточную инфильтрацию, на смену которой приходит стадия фиброза.
Тиреотоксический экзофтальм
Тиреотоксический экзофтальм встречается всегда на фоне тиреотоксикоза, чаще у женщин. Может быть односторонним. Сопровождается тремором рук, тахикардией, снижением массы тела, нарушением сна. Больные жалуются на раздражительность, постоянное чувство жара.
Глазная щель у таких больных распахнута, хотя экзофтальма при этом нет, либо он не превышает 2 мм (рис. 2). Увеличение глазной щели происходит за счет ретракции верхнего века (мышца Мюллера – средний пучок леватора верхнего века находится в состоянии спазма). При тиреотоксическом экзофтальме больные редко мигают, характерен пристальный взгляд. Могут быть обнаружены и другие микросимптомы: симптом Грефе (при взгляде книзу появляется отставание верхнего века и обнажается полоска склеры над верхним лимбом), нежный тремор век при их смыкании, но веки смыкаются полностью. Объем движений экстраокулярных мышц не нарушен, глазное дно остается нормальным, функции глаза не страдают. Репозиция глаза не затруднена. Использование инструментальных методов исследования, включая компьютерную томографию и ядерно-магнитный резонанс, доказывает отсутствие изменений в мягких тканях орбиты. Описанные симптомы исчезают на фоне медикаментозной коррекции дисфункции щитовидной железы.
Отечный экзофтальм
Отечный экзофтальм появляется как у женщин, так и у мужчин, возникает на фоне гипертиреоза (чаще), гипотиреоза или при эутиреоидном состоянии. Процесс, как правило, двусторонний, но поражение обоих глаз чаще происходит разновременно, интервал иногда составляет несколько месяцев. Начало патологического процесса знаменуется частичным интермиттирующим птозом: верхнее веко по утрам несколько опускается, к вечеру оно занимает нормальное положение, но при этом сохраняется тремор закрытых век. Глазная щель на этой стадии закрывается полностью. В дальнейшем частичный птоз быстро переходит в стойкую ретракцию верхнего века. В механизме ретракции принимают участие три фактора: спазм мышцы Мюллера (на первом этапе), который может быть кратковременным, а затем становится постоянным; постоянный спазм мышцы Мюллера приводит к повышению тонуса верхней прямой мышцы и леватора; длительный повышенный мышечный тонус вызывает возникновение контрактуры в мюллеровской и верхней прямой мышцах. В этот период развивается стационарный экзофтальм. Иногда появлению экзофтальма предшествует мучительная диплопия, обычно с вертикальным компонентом, так как первоначально страдает нижняя прямая мышца. Описанная картина представляет собой компенсированную стадию процесса (рис. 3). Появление белого хемоза у наружного угла глазной щели и вдоль нижнего века, а также возникновение невоспалительного отека периорбитальных тканей и внутриглазной гипертензии характеризуют собой стадию субкомпенсации. Морфологически в этот период находят резкий отек орбитальной клетчатки, интерстициальный отек и клеточную инфильтрацию экстраокулярных мышц (лимфоцитами, плазмоцитами, тучными клетками, макрофагами и большим количеством мукополисахаридов), последние оказываются резко увеличенными в 6–8, иногда в 12 раз (рис. 4). Экзофтальм нарастает достаточно быстро, репозиция глаза становится невозможной, глазная щель не закрывается полностью. В месте прикрепления экстраокулярных мышц к склере появляются застойно полнокровные, расширенные и извитые эписклеральные сосуды, которые формируют фигуру “креста”. Симптом “креста” – патогномоничный признак отечного экзофтальма. Внутриглазное давление остается нормальным только при положении глаза прямо. При взгляде кверху оно повышается на 3–6 мм рт.ст. за счет сдавления глаза увеличенными плотными верхней и нижней прямыми мышцами. Этот признак типичен для ЭОП и никогда не встречается при опухолях орбиты. По мере нарастания патологического процесса ЭОП переходит в стадию декомпенсации, для которой характерно агрессивное нарастание клинических симптомов: экзофтальм достигает больших степеней, появляется несмыкание глазной щели за счет резкого отека периорбитальных тканей и век, глаз неподвижен, возникает оптическая нейропатия, которая может достаточно быстро перейти в атрофию зрительного нерва. В результате сдавления цилиарных нервов развивается тяжелейшая кератопатия или язва роговицы (рис. 5). Без лечения отечный экзофтальм по истечении 12–14 мес завершается фиброзом тканей орбиты, что сопровождается полной неподвижностью глаза и резким снижением зрения (бельмо роговицы или атрофия зрительного нерва).
Эндокринная миопатия
Эндокринная миопатия – процесс двусторонний, возникает чаще у мужчин на фоне гипотиреоза или эутиреоидного состояния. Заболевание начинается с диплопии, интенсивность которой нарастает постепенно. Диплопия обусловлена резкой ротацией глаза в сторону, ограничением его подвижности. Постепенно развивается экзофтальм с затрудненной репозицией (рис. 6). Другие симптомы, присущие отечному экзофтальму, отсутствуют. Морфологически у таких больных не находят резкого отека орбитальной клетчатки, но имеется резкое утолщение одной или двух экстраокулярных мышц, плотность которых резко повышена. Стадия клеточной инфильтрации очень короткая, и через 4–5 мес развивается фиброз.
Лечение
Лечение ЭОП проводится совместно офтальмологом и эндокринологом с учетом степени тяжести заболевания и нарушения функции щитовидной железы. Непременным условием успешного лечения является достижение эутиреоидного состояния.
При гипотиреозе необходима заместительная терапия L-тироксином под контролем ТТГ.
При гипертиреозе показано лечение тиреостатиками (тиамазол), которое проводят длительно (12–18 мес) под контролем общего анализа крови (лейкоциты, тромбоциты) и тиреоидных гормонов. Возможно сочетание тиреостатиков с L-тироксином по принципу “блокирую и замещаю”.
При неэффективности консервативной терапии ДТЗ показано оперативное лечение, более предпочтительна тотальная ти реоидэктомия, так как у больных после неполного удаления щитовидной железы отмечается стойкое повышение антител к рецептору ТТГ, что может приводить к прогрессированию ЭОП. Необходимо помнить, что не только тиреотоксикоз, но и гипотиреоз любого генеза оказывает неблагоприятное влияние на течение ЭОП, причем ухудшение состояния глаз наблюдается при резком переходе от одного состояния к другому. Поэтому после оперативного лечения ДТЗ необходимо тщательно следить за уровнем тиреоидных гормонов крови и проводить профилактику и адекватное лечение гипотиреоза.
Нередко клиническая картина ЭОП развивается у лиц без клинических признаков нарушения функции щитовидной железы. У этих больных при обследовании можно выявить субклинический гипертиреоз (нормальные уровни тиреоидных гормонов и сниженный уровень ТТГ), субклинический гипотиреоз (нормальные уровни тиреоидных гормонов и повышенный уровень ТТГ) или отсутствие патологических изменений. В последнем случае показано проведение пробы с тиролиберином (200–500 мкг внутривенно струйно) с определением уровня ТТГ исходно и через 30 мин после введения. В дальнейшем больной наблюдается у эндокринолога, проводится динамический контроль тиреоидного статуса. Лечение начинают при манифестации гипер- или гипотиреоза.
Лечение ЭОП казуальное, симптоматическое и восстановительное. Казуальную терапию кортикостероидами назначают при субкомпенсации и декомпенсации процесса. Суточная доза их зависит от длительности заболевания, степени агрессивности глазных симптомов и составляет 40–80 мг/сут в пересчете на преднизолон. При резкой декомпенсации процесса, когда имеется угроза потери глаза, назначают дексаметазон по 4 мг каждые 4–8 ч в течение 3–4 сут или пульс-терапию по схеме. При давности заболевания, не превышающей 12–14 мес, стероидную терапию можно комбинировать с наружным облучением орбит.
Симптоматическое лечение заключается в назначении пациенту антибактериальных капель, искусственной слезы, солнцезащитных очков и обязательно глазной мази на ночь. Восстановительное хирургическое лечение назначают при эндокринной миопатии с целью улучшения функций пораженных экстраокулярных мышц [1] или при резкой ретракции верхнего века для восстановления его нормального положения.
Литература
1. Бровкина А.Ф. Болезни орбиты. М.,1993.
2. Руководство по медицине. Под ред. Р. Беркоу. М., 1997; 1: 730–3.
3. Advances in Thyroid Eye Disease.International Satellite Symposium of 25 Annual Meeting of the Thyroid Association.Thyroid 1998; 8: 407–71.
4. Burman K.D. Eur J Endocrinol 1997; 136: 583–5.
5. Kahaly G., Forster G., Pitz S. et al. DtschMedWochenschrb 1997; 122: 27–32.
6. Kahaly G., Otto E., Forster G. et al. Exp Clin Endocrinol. Diabetes 1996; 104: 79–83.
7. Pappa A., Calder V., Ajjan R. et al. Clin Exp Immunol 1997; 109: 362–9.
8. Gracia-Naya M., Uson M., Lopez-Lopez A. Rev Neurol 1995; 23: 1059–62.
9. Bahn R.S., Dutton C.M., Natt N. et al. J Clin Endocrinol Metab 1998; 83: 998–1002.
10. Weetman A.P. Autoimmunity 1992; 12: 215–22.
11. Kubota S., Gunji K., Stolarski S. et al. Thyroid 8: 1998; 175–9.
12. Wu Y.J., Clarke E.M.S., Shepherd P. Thyroid 1998; 8: 167–74.
13. Heufelder A.E., Hofbauer L.C., Schworm H.D. Die Medizinische Welt 1997; 48: 230–8.
14. Wiersinga W.M. Thyroid International 1997; 3.
Ломефлоксацин –
Окацин (торговое название)
CIBA VISION A Novartis Company
Приложения к статье
Эндокринная офтальмопатия – аутоиммунное заболевание, проявляющееся патологическими изменениями в мягких тканях орбиты с вторичным вовлечением глаза
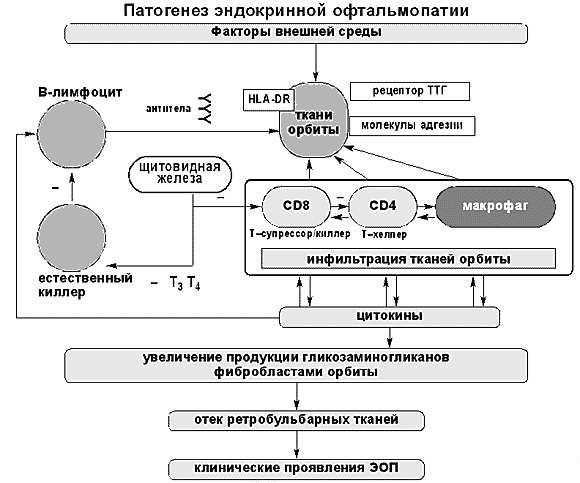
Рис. 1. Схема патогенеза ЭОП
Симптом “креста” – патогномоничный признак отечного экзофтальма
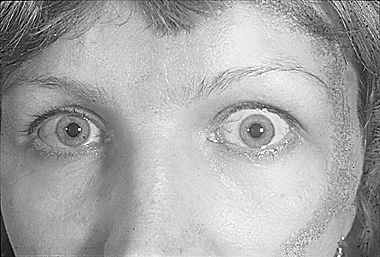
Рис. 2. Тиреотоксический экзофтальм
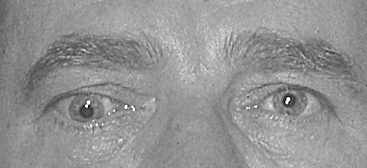
Рис. 3. Отечный экзофтальм в стадии компенсации
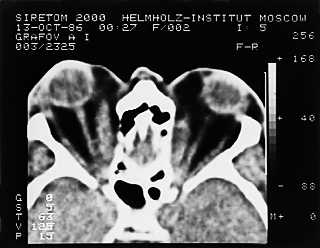
Рис. 4. Компьютерная томограмма орбит при отечном экзофтальме:
видны резко утолщенные экстраокулярные мышцы
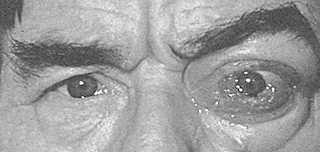
Рис. 5. Отечный экзофтальм в стадии декомпенсации
Непременным условием успешного лечения ЭОП является достижение
эутиреоидного состояния
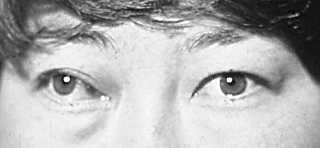
Рис. 6. Эндокринная миопатия
